1、填空题 (8分)某一离子反应体系有反应物和产物共以下六种:MnO4-、H+、O2、H2O、H2O2、Mn2+,
已知该反应中的H2O2只发生如下过程: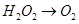
(1)该反应中的还原剂是 ,还原产物是________。
(2)KMnO4溶液随着酸性的增强氧化性不断增强,应选择_______(选填 “稀硫酸”或“浓盐酸”)进行KMnO4溶液的酸化。
(3)假如反应转移了0.3mol电子,则产生的气体在标准状况下体积为________。
参考答案:(8分)(每空2分)
(1)H2O2,Mn2+ (2)稀硫酸 (3)3.36L
本题解析:(1)H2O2发生的反应为:H2O2 O2,O元素化合价升高,所以还原剂是H2O2;所给物质中具有强氧化性的是MnO4?,所以还原产物是Mn2+。
O2,O元素化合价升高,所以还原剂是H2O2;所给物质中具有强氧化性的是MnO4?,所以还原产物是Mn2+。
(2)浓盐酸具有还原性,酸性KMnO4溶液可以氧化HCl,所以应选择稀硫酸酸化。
(3)反应H2O2 O2,O元素由-1价升高到0价,所以O2与电子转移对应关系为:O2~2e?,则反应转移了0.3mol电子,生成的O2为0.15mol,故产生的气体在标准状况下体积为3.36L。
O2,O元素由-1价升高到0价,所以O2与电子转移对应关系为:O2~2e?,则反应转移了0.3mol电子,生成的O2为0.15mol,故产生的气体在标准状况下体积为3.36L。
考点:本题考查氧化还原反应原理及计算。
本题难度:一般
2、选择题 根据下列各反应,判断有关物质还原性由强到弱的顺序是
① H2SO3+I2+H2O = 2HI + H2SO4
② 2FeCl3+2HI=2FeCl2 + 2HCl + I2
③ 3FeCl2 + 4HNO3=2FeCl3 + NO↑ + 2H2O +Fe(NO3)3
A.FeCl2>HI>H2SO3>NO
B.H2SO3>HI>FeCl2>NO
C.I2>FeCl2>H2SO3>NO
D.NO>FeCl2>H2SO3>HI
参考答案:B
本题解析:试题分析:在氧化还原反应中,还原剂的还原性大于还原产物的还原性。①还原剂:H2SO3,还原产物:HI 还原性:H2SO3>HI。②还原剂:HI ,还原产物:FeCl2。还原性:HI>FeCl2。③还原剂:FeCl2?,还原产物: NO。还原性:FeCl2>NO。所以还原性:H2SO3>HI>FeCl2>NO。选项为:B
考点:考查氧化还原反应中氧化性、还原性强弱的比较是知识。
本题难度:一般
3、选择题 将标准状况下体积为2.24L的H2S缓慢通入100ml, 1.5mol/LNaOH溶液中(溶液体积变化忽略不计),充分反应,下列关系错误的是
A.c(Na+)+ c(H+)= c(HS-)+2 c(S2-)+ c(OH-)
B.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)
C.c(Na+)>[c(HS-)+c(S2-)+c(H2S)]
D.c(HS-)+c(S2-)+c(H2S)=1.0mol/L
参考答案:B
本题解析:试题分析:H2S的物质的量是0.1mol,氢氧化钠的物质的量是0.15mol,这说明反应后生成的是等物质的量浓度的Na2S和NaHS,溶液显碱性,B不正确;A符合电荷守恒,正确;C和D符合符合物料守恒,正确,答案选B。
考点:考查H2S和氢氧化钠溶液反应后溶液中离子浓度大小比较
点评:该题是高考中的常见考点和题型,属于中等难度的试题。试题贴近高考,综合性强,注重考查学生分析问题、解决问题的能力。该题的关键是准确判断出溶液中的溶质,然后结合各种守恒即可得出正确的结论。
本题难度:简单
4、选择题 下列过程需加入还原剂才能实现的是( )
A.KMnO4→MnO2
B.HCO3-→CO2↑
C.HCl→Cl2
D.Cu2+→Cu