1、选择题 下列各组物质相互反应时,会产生有色气体的是
A.Zn与H2SO4
B.NH4Cl与浓NaOH溶液
C.NaHCO3与稀H2SO4
D.Cu与浓HNO3
参考答案:D
本题解析:分析:A.氢气为无色气体;
B.氨气为无色刺激性气味的气体;
C.二氧化碳为无色无味的气体;
D.二氧化氮为红棕色的气体.
解答:A.Zn与H2SO4反应生成硫酸锌和氢气,得到无色气体,故A不选;
B.NH4Cl与浓NaOH溶液反应生成氯化钠、氨气、水,得到无色气体,故B不选;
C.NaHCO3与稀H2SO4反应生成硫酸钠、水和二氧化碳,得到无色气体,故C不选;
D.Cu与浓HNO3反应生成硝酸铜、二氧化氮、水,得到红棕色气体,故D选;
故选D.
点评:本题考查硝酸的性质,明确发生的化学反应及反应中气体的颜色是解答本题的关键,注意稀硫酸不具有强氧化性,浓硫酸具有强氧化性,题目难度不大.
本题难度:一般
2、选择题 将质量为m?g的铁粉与铜粉的混合物,溶于足量的稀HNO3溶液,充分反应后得到标准状况下1.12L的NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.(m+25.5)g
B.(m+1.7)g
C.(m+3.4)g
D.(m+2.55)g
参考答案:D
本题解析:分析:加入足量的NaOH溶液得到沉淀为氢氧化铁、氢氧化铜,根据电荷守恒可知,沉淀中氢氧根的物质的量等于金属提供的电子的物质的量,根据生成的NO利用电子转移守恒计算金属提供的电子的物质的量,沉淀质量等于金属质量与氢氧根质量之和.
解答:加入足量的NaOH溶液得到沉淀为氢氧化铁、氢氧化铜,根据电荷守恒可知,沉淀中氢氧根的物质的量等于金属提供的电子的物质的量.标准状况下1.12LNO的物质的量为 =0.05mol,根据电子转移守恒可知金属提供的电子的物质的量为0.05mol×(5-2)=0.15mol,所以沉淀质量为mg+0.15mol×17g/mol=(m+2.55)g.
=0.05mol,根据电子转移守恒可知金属提供的电子的物质的量为0.05mol×(5-2)=0.15mol,所以沉淀质量为mg+0.15mol×17g/mol=(m+2.55)g.
故选:D.
点评:考查氧化还原反应的计算等,难度中等,判断沉淀中氢氧根的物质的量等于金属提供的电子的物质的量是解题关键.
本题难度:一般
3、选择题 将一定质量的铁投入10.0ml某浓度的HNO3中恰好完全溶解,将产生的气体全部收集并与672ml(标况)O2混合恰好能完全被吸收,在铁和HNO3反应得到的溶液中滴加稀硫酸直至不再产生气体为止,又收集到无色气体224ml.则原来投入的铁的质量是
A.4.20g
B.2.80g
C.28.0g
D.42.0g
参考答案:B
本题解析:分析:在铁和HNO3反应得到的溶液中滴加稀硫酸有气体产生,说明溶液含有Fe(NO3)2,根据NO的体积计算溶液中反应消耗的Fe的物质的量,根据加硫酸后发生反应计算Fe+Fe(NO3)3=2Fe(NO3)2?中消耗Fe的物质的量,即可计算总共消耗铁的物质的量,进而计算铁的质量.
解答:在铁和HNO3反应得到的溶液中滴加稀硫酸有气体产生,说明溶液含有Fe(NO3)2,
一定质量的铁投入10.0ml某浓度的HNO3中恰好完全溶解,发生反应分别为:
①Fe+4HNO3=Fe(NO3)3+2H2O+NO↑
②Fe+2Fe(NO3)3=3Fe(NO3)2? (过量的铁跟硝酸铁反应)
③4NO+3O2+2H20=4HNO3?
由③可知672mLO2等于0.03mol,NO的物质的量为0.04mol.
反应①中消耗的Fe为0.04mol,
加硫酸后发生反应④3Fe2++4H++NO3-=3Fe3++2H2O+NO,
NO气体224ml等于0.01mol,则Fe2+有0.03mol(Fe2+是反应②所提供的),
则反应②中消耗Fe0.01mol,
Fe共有0.04+0.01=0.05mol,
质量为0.05mol×56g/mol=2.80g,
故选B.
点评:本题考查混合物的计算,题目难度中等,注意把握发生反应的可能性,从而计算消耗铁的质量.
本题难度:困难
4、选择题 将下列各组内等体积等物质的量浓度的溶液相混合,有白色沉淀生成,加入过量稀硝酸后,沉淀消失并放出气体,再加入AgNO3溶液又有白色沉淀生成的是
A.Na2CO3和Ca(OH)2
B.Na2CO3和CaCl2
C.Ca(HCO3)2和NaOH
D.Na2SO4和Ba(NO3)2
参考答案:B
本题解析:分析:等体积等物质的量浓度的溶液相混合,有白色沉淀生成,说明能发生复分解反应且生成不溶于水的白色沉淀,加入过量稀硝酸后,沉淀消失并放出气体,说明白色沉淀是弱酸盐,且该弱酸盐不能被硝酸氧化,再加入AgNO3溶液又有白色沉淀生成说明原来溶液中含有氯离子.
解答:A.Na2CO3和Ca(OH)2等浓度等体积混合产生白色沉淀,Ca2++CO32-=CaCO3↓,加入过量硝酸发生反应,OH-+H+=H2O;CaCO3+2H+=CO2↑+H2O+Ca2+;再加入AgNO3溶液无白色沉淀生成,故A不符合;
B.Na2CO3和CaCl2等浓度等体积混合产生白色沉淀,Ca2++CO32-=CaCO3↓,加入过量硝酸发生反应,CaCO3+2H+=CO2↑+H2O+Ca2+;再加入AgNO3溶液,Ag++Cl-=AgCl↓,有白色沉淀生成,故B符合;
C.氢氧化钠和碳酸氢钙反应生成碳酸钙白色沉淀,碳酸钙和硝酸反应生成二氧化碳和硝酸钙,硝酸钙和硝酸银不反应,所以不能产生白色沉淀,故C不符合;
D.Na2SO4和Ba(NO3)2等浓度等体积混合产生白色沉淀,Ba2++SO42-=BaSO4↓,加入过量硝酸不发生反应,无沉淀消失和气体生成,故D不符合;
故选B.
点评:本题考查了溶液中离子反应的实质、离子的性质判断,明确物质的性质及物质间的反应是解本题关键,难度中等.
本题难度:一般
5、选择题 在一定条件下,将金属钠与氧气反应的生成物7.0g溶于水,所得溶液恰好被100g?质量分数为9.8%的硫酸溶液完全中和,则该氧化物的成分为
A.Na2O
B.Na2O2
C.Na2O和Na2O2
D.NaO2和Na2O2
参考答案:C
本题解析:分析:由于不知道产物是 Na2O还是Na2O2,或者二者都有,因此设定一个化学式Na2OX,算出摩尔质量,与两种氧化物的对比即可判断.
解答:n(硫酸)=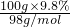 =0.1mol,
=0.1mol,
溶液恰好能被100g?质量分数为9.8%的硫酸溶液中和,
则? Na2OX ~2NaOH~H2SO4
?0.1mol?0.1mol
则Na2OX平均摩尔质量M=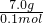 =70g/mol,介于Na2O(62g/mol)和Na2O2(78g/mOl)之间,因此,一定条件下钠与氧气反应的生成物是Na2O 和Na2O2,
=70g/mol,介于Na2O(62g/mol)和Na2O2(78g/mOl)之间,因此,一定条件下钠与氧气反应的生成物是Na2O 和Na2O2,
故选C.
点评:本题主要考查的钠与氧气反应产物的判断,若用极限法计算,计算比较繁琐,而用平均摩尔质量来求,则比较简单.
本题难度:简单