1、选择题 下列反应的离子方程式正确的是( )
A.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
B.往碳酸钡中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++3OH-=Al(OH)3↓
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
参考答案:A、氢氧化铜和盐酸发生酸碱中和反应生成盐和水,实质是:Cu(OH)2+2H+=Cu2++2H2O,故A正确;
B、碳酸钡是难溶于水的盐类,不能拆成离子形式,应改为:BaCO3+2H+=CO2↑+H2O+Ba2+,故B错误;
C、氨水属于弱碱,不能拆成离子形式,应改为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+,故C错误;
D、氢氧化钡溶液与稀硫酸反应的实质是:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O,故D错误.
故选A.
本题解析:
本题难度:简单
2、选择题 下列离子方程式不正确的是( )
A.氯化铁溶于水:Fe3++3H2O=Fe(OH)3+3H+
B.NaOH溶液与盐酸反应:H++OH-=H2O
C.Cl2气通入烧碱溶液中:Cl2+2OH-=Cl-+ClO-+H2O
D.Na投入大量水中:2Na+2H2O=2Na++2OH-+H2↑
参考答案:A、盐的水解是可逆的,用可逆符号,盐的水解是微弱的不能加沉淀符号,正确的离子方程式为:Fe3++3H2O?Fe(OH)3+3H+,故选A;
B、强酸和强碱中和生成可溶性的盐,正确的离子方程式为::H++OH-=H2O,故B不选;
C、氯气自身的氧化还原反应,正确的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故C不选;
D、钠与水电离出的氢离子之间的氧化还原反应,正确的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故D不选.
故选A.
本题解析:
本题难度:简单
3、选择题 下列离子方程式中正确的是 (? )
A.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液使SO42-沉淀完全Ba2++NH4++Al3++SO42- +4OH—="==" Al(OH)3↓ + BaSO4↓+ +NH3.H2O
B.向Ba(OH)2溶液中加入少量NaHSO3溶液: HSO3— + Ba2++ OH— = BaSO3↓ + H2O
C. Fe(OH)3溶于氢碘酸: Fe(OH)3+3H += Fe3++3H2O
D.向Na2S2O3溶液中通入足量的氯气:S2O32-+2Cl2+3H2O ="=" 2SO3 2-+4Cl-+ 6H+
参考答案:B
本题解析:A不正确,应该是2Ba2++NH4++Al3++2SO42- +4OH—?="==" Al(OH)3↓ +2 BaSO4↓+ +NH3.H2O。铁离子具有氧化性,能氧化碘离子,所以选项C中生成物是水、碘化亚铁、单质碘,C不正确。氯气具有氧化性,生成物应该是SO42-,而不是SO32-,D不正确。所以正确的答案选B。
本题难度:一般
4、填空题 (10分)如下图所示,烧杯中都盛有稀硫酸。
(1)中反应的离子方程式为? ?,
?,
(2)中的电极反应:Fe:?、Sn:?
Sn极附近溶液的pH(填增大、减小或不变)?
(3)中被腐蚀的金属是?。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是?(用序号回答)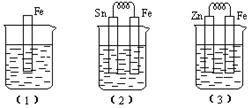
参考答案:(10分 ) (1)Fe + 2H+ = Fe2+ + H2↑
) (1)Fe + 2H+ = Fe2+ + H2↑
(2)Fe + 2e- = Fe2+? 2H+ + 2e- = H2↑?增大? (3) Zn?(2)(1)(3)
本题解析:略
本题难度:简单
5、选择题 能正确表示下列反应的离子方程式是( )。
A.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+
2Cu+O2↑+4H+
B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+
C.明矾溶于水产生Al(OH)3胶体:Al3++3H2O=Al(OH)3↓+3H+
D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+
参考答案:D
本题解析:用铜做电极电解CuSO4溶液,阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu,A错;钠与CuSO4溶液反应,Na先与水反应,生成的NaOH再与硫酸铜反应,B错;铝离子水解不能进行到底,中间用可逆符号,生成的是Al(OH)3胶体,不写沉淀符号,C错。
本题难度:一般