1、选择题 某同学用量筒量取液体时,将量筒平放,仰视液体凹液面最低处读数为16.0mL,倾倒出一部分溶液,又俯视液体凹液面最低处,读数为10.0mL,该同学取出液体的体积是
[? ]
A.大于6.0mL
B.等于6.0mL
C.小于6.0mL
D.无法判断
参考答案:B
本题解析:
本题难度:简单
2、选择题 下述实验能达到预期目的的是
[? ]
实验内容?
实验目的?
A.
用10mL的量筒量取一定体积的液体
量取9.40 mL盐酸
B.
将Na投入到CuSO4溶液中置换出铜
证明钠的金属性比铜强
C.
将乙酸乙酯和稀硫酸混合加热一段时间冷却后,加Na2CO3溶液
证明乙酸乙酯水解生成乙酸
D.
向浓氨水中加入生石灰
制取NH3
参考答案:D
本题解析:
本题难度:简单
3、实验题 电解法制碱的主要原料是饱和食盐水,由于粗盐水中含有泥沙、Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐;
请回答以下问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器。
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为________________。
(3)步骤2中,判断加入BaCl2已过量的方法是:___________________________。
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是_________________。
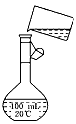
(5)为检验精盐纯度,需配制150 mL 0.2 mol/L NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的两处错误是: ________________、________________。若在定容时仰视,则所配溶液的浓度
______0.2 mol/L(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是___________________________。
参考答案:(1)玻璃棒;漏斗
(2)NaOH→BaCl2→Na2CO3(或BaCl2→NaOH→Na2CO3)
(3)取所得溶液的上层清液1~2滴于滴定板上,再滴入1~2滴BaCl2溶液,若溶液未变混浊,则表明
BaCl2已过量
(4)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(5)未用玻璃棒引流;未采用150 mL容量瓶;小于;重新配制
本题解析:
本题难度:一般
4、填空题 用如图所示装置(夹持仪器省略)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
(1)图中D装置在实验中的作用是______.
(2)若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中出现浅黄色浑浊的现象,写出C中发生反应的化学方程式为______.
(3)若A为浓氨水,B为生石灰,C中盛有AlCl3溶液,旋开E,足够长的时间后,C中的现象是______,C中发生反应的离子方程式为______.
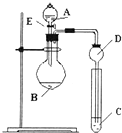
参考答案:(1)如生成气体极易溶于C中液体,则C中液体上升,因C的球形部分体积较大,当C中液体脱离液面时,由于自身重力作用可回落到C中,从而可起到防止倒吸作用,
故答案为:防倒吸;
(2)氧气和硫化氢发生氧化还原反应可生成硫单质,反应的化学方程式为2H2S+O2=2S↓+2H2O,故答案为:2H2S+O2=2S↓+2H2O;
(3)生石灰与水反应生成氢氧化钙,反应放出大量的热,可使氨气挥发,生成氨气溶于水呈碱性,且一水合氨为弱碱,则与氯化铝反应生成氢氧化铝沉淀,反 应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+,
故答案为:有白色沉淀生成;Al3++3NH3?H2O=Al(OH)3↓+3NH4+.
本题解析:
本题难度:简单
5、选择题 某课外实验小组设计的下列实验不合理的是
[? ]
A.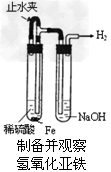
B.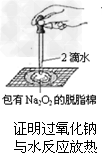
C.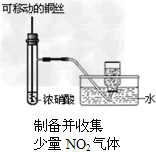
D.
参考答案:C
本题解析:
本题难度:一般