1、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
[? ]
A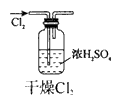
B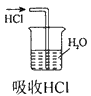
C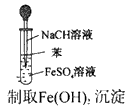
D
参考答案:C
本题解析:
本题难度:一般
2、实验题 无水硫酸铜在强热下会发生分解反应:
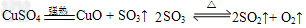
用下图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量。
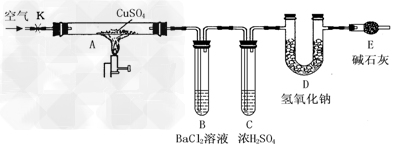
实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气。
④再称量D管,得其反应前后的质量差为m。
回答下列问题:
(1)2SO3(g) 2SO2(g)?+?O2(g)?该反应的平衡常数表达式为K=____________。
2SO2(g)?+?O2(g)?该反应的平衡常数表达式为K=____________。
(2)B管中除温度明显升高外,还可看到的现象是________________________,而温度明显升高的主要原因是_____________;B管中发生反应的有关离子方程式是_______________。
(3)步骤③中通一段时间已除去二氧化碳等酸性气体的空气的目的是?____________。
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为_____________(用m表示)。
②如果不能,则原因是_______________。为了能测得分解了的无水硫酸铜的质量,你的简单实验方案是__________________。
参考答案:(1)K=c(O2)·c2(SO2)/c2(SO3)
(2)?有气泡冒出,产生白色沉淀;SO3溶于水放热;SO3?+?H2O?+?Ba2+=?BaSO4↓+?2H+或SO3?+?H2O?=?2H++?SO42-和Ba2++?SO42-=?BaSO4↓
(3)使残留在装置中的SO2、SO3被充分吸收
(4)?①:“略”
②:SO3不能完全分解为SO2和O2,SO2会部分溶解在溶液中;称量装有无水硫酸铜的A管质量,强热一段时间后,冷却后再称量A管质量,根据A管在反应前后的质量差计算出分解了的无水硫酸铜的质量
本题解析:
本题难度:困难
3、选择题 除去粗盐溶液中的Ca2+、Mg2+、SO42-等杂质,需依次加入稍过量的NaOH溶液、X溶液、Y溶液,最终滴加稀盐酸调至中性.其中X、Y分别是( )
A.Na2CO3,Ba(NO3)2
B.Na2CO3,AgNO3
C.Na2CO3,BaCl2
D.BaCl2,Na2CO3
参考答案:粗盐提纯时,若先加稍过量的NaOH溶液,则后加过量的氯化钡除去硫酸根离子,接着加碳酸钠去除去钙离子和过量的钡离子,最后加盐酸来除去过量的氢氧化钠和碳酸钠,所以X溶液、Y溶液分别为:BaCl2,Na2CO3,故选:D;
本题解析:
本题难度:简单
4、简答题 现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CaCl2、CuSO4.进行如下实验:①溶于水得无色溶液;②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失.据上述实验现象推断:
(1)由实验①可以得出的结论是______;
(2)由实验②可以得出的结论是______;可能存在的物质是______;
(3)对于可能存在的物质应如何进一步检验?写出简要步骤、现象和结论.______.
(4)写出实验②所涉及的离子方程式.______.
参考答案:①根据固体加入水中,得到无色溶液.说明混合物中不含有颜色的CuSO4.同时由于不存在沉淀,则原混合物中不含有不溶于水的CaCO3;
②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,说明原混合物中一定不含Na2SO4,因为硫酸钡不溶于酸;能生成白色沉淀的物质只能是Na2CO3,由此也确定了不含有CaCl2;
综上所述,原混合物中一定含有 Na2CO3,一定不存在CaCO3、CuSO4、Na2SO4、CaCl2,NaCl无法确定;
检验氯化钠的存在需要检验氯离子的存在,利用实验步骤①所得溶液取少许与试管中,加入硝酸酸化的硝酸银溶液,产生不是沉淀证明含有NaCl,不产生白色沉淀,说明不含NaCl;
实验②所涉及的反应是碳酸钠与氯化钡的反应,碳酸钡溶于盐酸的反应,根据反应的实质写出离子方程式为
Ba2++CO32-=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;
故答案为:
(1)一定不存在CaCO3、CuSO4,不可能同时存在Na2CO3、CaCl2;
(2)一定存在Na2CO3,一定不存在Na2SO4,CaCl2?NaCl;
(3)取实验①的溶液少许于试管中,向其中加入硝酸酸化的硝酸银溶液,如果产生白色沉淀,证明含有NaCl,反之则无;
(4)Ba2++CO32-=BaCO3↓;BaCO3+2H+=Ba2++CO2↑+H2O;
本题解析:
本题难度:一般
5、填空题 根据所学知识回答下列问题:
(1)下列仪器中:①燃烧匙 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管
常用于物质分离的是___________(填序号) 。
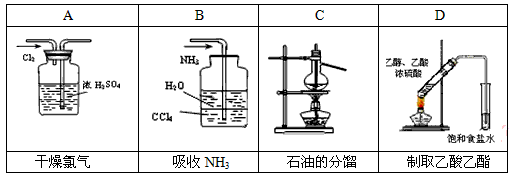
(2)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。
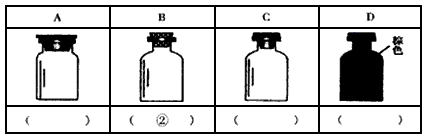
(3)下图是常见的试剂瓶。请将下列试剂的序号填写在相应试剂瓶的括号内:
①大理石 ②碳酸钠溶液 ③浓硫酸 ④氯水 ⑤酒精 ⑥浓硝酸
参考答案:(1)③⑤
(2)B
(3)A:①;C:③⑤;D:④⑥
本题解析:
本题难度:一般