1、选择题 在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确的是
[? ]
A.电子从原电池的负极通过导线移向正极
B.电子从原电池的正极通过导线移向负极
C.阴离子在电解质溶液中向正极移动
D.阳离子在电解质溶液中向正极移动
参考答案:AD
本题解析:
本题难度:简单
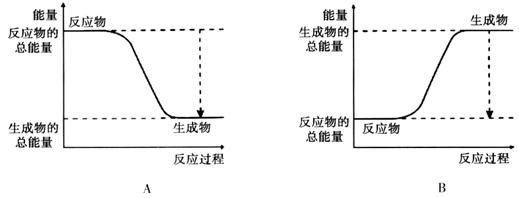
2、填空题 (12分)(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,下图能正确表示该反应中能量变化的是________。
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:
化学键
| H—H
| O=O
| H—O
|
键能kJ/mol
| 436
| 496
| 463
|
则生成1mol水可以放出热量 kJ
(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是 (填“Cu”或“Fe”); 若Zn、Ag和稀盐酸构成原电池,正极发生 反应(填“氧化”或“还原”),电解质溶液中阳离子移向 极(填“正”或“负”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为 。
参考答案:(1)A; 242 ; (2) Cu ;还原; 正; 0.2;
(3)0.2mol/(L.min) ; 2; 小于; 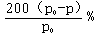 。
。
本题解析:(1)从能量的变化和反应的快慢等角度研究反应:2H2 + O2 = H2O。 已知该反应为放热反应,则反应物的能量高于生成物的能量,所以下图能正确表示该反应中能量变化的是A。则生成1mol水可以放出热量是2×463-436-496×1/2=242(KJ)。(2)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,由于在室温下Fe在浓硝酸中会发生钝化,所以活动性较弱的Cu作负极;若Zn、Ag和稀盐酸构成原电池,则活动性强的Zn作负极,Ag作正极,在正极上发生H+得到电子变为氢气,发生还原反应;根据同种电荷相互排斥,异种电荷相互吸引的原则,电解质溶液中阳离子移向负电荷较多的正极;质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中Zn作负极,被氧化,若一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。根据反应方程式Zn+Cu2+=Zn2++Cu,可知每消耗65g锌,在正极就产生64g的Cu,两个电极质量相差129g,转移电子2mol,现在二者质量差为12.9 g,所以导线中通过的电子的物质的量是0.2mol;(3)根据题意可知反应消耗A1.2mol,则同时会消耗B0.4mol,所以v(B)= 0.4mol÷2L÷1min=0.2mol/(L.min); v(C)= 0.4mol/L÷1min=0.4mol/(L.min); v(B):v(C)=1:2.所以x="2;" 若反应经2min达到平衡,因为反应是在体积固定的容器内进行,随着反应的进行,物质的浓度会减小,速率会减慢,所以前1minC变化浓度是0.4mol/L,后1min内C的浓度变化会小于0.4mol/L。因此若反应经2min达到平衡,平衡时C的浓度<0.8mol/L, 在体积固定的密闭容器内进行的化学反应,容器内气体的压强之比等于它们的物质的量的比。 3A(g)+B(g) 2C(g),
2C(g),
反应开始时气体的物质的量(mol) 3 1 0
反应消耗气体的物质的量(mol x x/3 2x/3
平衡时气体的物质的量(mol) 3-x 1-x/3 2x/3
[(3-x) +(1-x/3)+2x/3]÷(3+1)= p/p0;
解得x=6(p0-p)/ p0.
所以A的转化率是(x÷3)×100%={[6(p0-p)/ p0]÷3]} ×100%=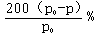 .
.
考点:考查原电池反应原理、反应热、方程式系数的确定、化学反应速率、物质的转化率的计算的知识。
本题难度:一般
3、填空题 (9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
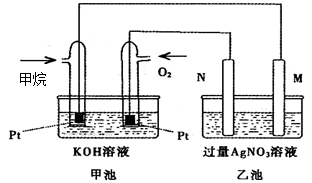
(1)M电极的材料是 ,N的电极电极反应式为: ;乙池的总反应式是 ,通入甲烷的铂电极上发生的电极反应式为 __________________________ 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为 。
参考答案:(9分)(1) 铁 , 4 OH- - 4 e- = O2 ↑ + 2H2O ,
4AgNO3+2H2O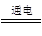 4Ag+ O2↑+4HNO3, CH4-8e-+10OH-= CO32-+7H2O 。
4Ag+ O2↑+4HNO3, CH4-8e-+10OH-= CO32-+7H2O 。
(2) 0.224 L, 0.1mol/L (每空1分)
本题解析:(1)甲是燃料电池,通入甲烷的电极是负极,通入氧气的是正极。所以M是阴极,N是阳极。由于工作时M、N两个电极的质量都不减少,所以M是铁,N是石墨,溶液中OH-放电,所以其电极反应式是4 OH- - 4 e- = O2 ↑ + 2H2O,则乙池中总的反应式是4AgNO3+2H2O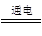 4Ag+ O2↑+4HNO3。由于原电池中电解质溶液显碱性,所以负极的电极反应式是CH4-8e-+10OH-= CO32-+7H2O 。
4Ag+ O2↑+4HNO3。由于原电池中电解质溶液显碱性,所以负极的电极反应式是CH4-8e-+10OH-= CO32-+7H2O 。
(2)4.32g银的物质的量是0.04mol,则转移电子是0.04mol。所以根据电子的得失守恒可知,消耗0.01mol氧气,标准状况下的途径是0.224L。根据乙池中的总反应式可知,此时生成硝酸是0.04mol,所以氢离子的浓度是0.04mol÷0.4L=0.1mol/L。
本题难度:一般
4、选择题 下列对于电化学说法正确的是( )
A.电解精练铜时,阳极泥中常含有金属金、银、锌等
B.为保护浸入海水中的钢闸门,可在闸门表面镶上铜锭
C.充电电池放电时,化学能转变为电能
D.铅蓄电池放电时的负极和充电时的阴极均发生氧化反应
参考答案:A.电解精练铜时,阳极泥中常含有金属金、银等,Zn比Cu活泼,则阳极泥中不含有Zn,故A错误;
B.Cu的活泼性比Fe的弱,Cu作正极,不能保护Fe,所以为保护浸入海水中的钢闸门,一般在闸门表面镶上锌锭,故B错误;
C.充电电池,放电时为原电池,则化学能转变为电能,故C正确;
D.原电池中负极发生氧化反应,电解池中阴极发生还原反应,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 下列各变化中,属于原电池反应的是
[? ]
A.在空气中金属铝表面迅速氧化成保护层
B.白铁(含锌)表面有划损时,也能阻止铁被氧化
C.红热的铁丝与水接触表面形成的保护层
D.铁与H2SO4反应时,加入少量ZnSO4溶液时,可使反应加速
参考答案:B
本题解析:
本题难度:一般