1、选择题 已知2H2(g)+O2(g)═2H2O(l);△H=-569.6kJ?mol-1,2H2O(g)═2H2(g)+O2(g);△H=+482.1kJ?mol-1.现有1g液态H2O,蒸发时吸收的热量是( ?)
A.2.43kJ
B.4.86kJ
C.43.8kJ
D.87.5kJ
参考答案:A
本题解析:
本题难度:简单
2、计算题 在一定条件下,CH4和CH3OH的燃烧的热化学方程式分别为:
CH4(g)+2O2(g)=CO2(g) + 2H2O(g) ΔH=-890kJ/mol
CH3OH(g)+1.5O2(g)=CO2(g) + 2H2O(g) ΔH=-750kJ/mol
如果有CH4和CH3OH的混合气体充分燃烧,放出的热量为806kJ,将生成的气体通过浓硫酸,浓硫酸增重36g。则混合气体中CH4和CH3OH的体积比________。?
参考答案:2:3
本题解析:
本题难度:一般
3、简答题 ①CaCO3(s)=CaO(s)+CO2(g);△H1=+175.7kJ/mol,
②C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol.
求1t碳酸钙生成生石灰理论上需含杂质10%焦炭多少千克?
参考答案:1t 碳酸钙生成生石灰,依据热化学方程式计算可知吸收热量=1×106g×175.7KJ100g=1.75×106KJ;
设理论上需含杂质10%焦炭x千克
C(s)+O2(g)=CO2(g);△H2=-393.5kJ/mol
12g 393.5KJ
x×1000×(1-10%)1.757×106KJ
x=60kg,
答:1t 碳酸钙生成生石灰理论上需含杂质10%焦炭60千克.
本题解析:
本题难度:一般
4、选择题 相同状况下:H2(g)+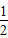 O2(g)=H2O(g);△H=-Q1?kJ/mol;2H2(g)+O2(g)=2H2O(l);△H=-Q2?kJ/mol
O2(g)=H2O(g);△H=-Q1?kJ/mol;2H2(g)+O2(g)=2H2O(l);△H=-Q2?kJ/mol
则Q1和Q2的关系为( )
A.Q1>Q2
B.Q1=Q2
C.2Q1<Q2
D.Q1=1/2Q2
参考答案:C
本题解析:
本题难度:简单
5、选择题 西气东输工程使东部发达地区的居民告别了管道煤气用上了天然气。已知某管道煤气的主要成分是H2和
CO,天然气的主要成分是CH4,它们燃烧的热化学方程式为
2H2(g)+O2(g)=2H2O(l) △H=-571. 6kJ/mol
2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890. 31kJ/mol
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的可燃气体,理论上所获得的热量,后者大约是前者的多少倍
[? ]
A.1.3
B.1.6
C.3.1
D.0.8
参考答案:C
本题解析:
本题难度:一般