1、选择题 下列推断正确的是( )
A.根据同浓度的两元素含氧酸钠盐(正盐)溶液的碱性强弱,可判断该两元素非金属性的强弱
B.根据同主族两非金属元素氢化物沸点高低,可判断该两元素非金属性的强弱
C.根据相同条件下两主族金属单质与水反应的难易,可判断两元素金属性的强弱
D.根据两主族金属元素原子最外层电子数的多少,可判断两元素金属性的强弱
参考答案:A、元素的最高价含氧酸的酸性越强,则该元素非金属性越强,故A错误;
B、氢化物沸点高低与晶体类型等因素有关,和元素的非金属性强弱没有必然联系,故B错误;
C、元素的单质与水反应的越容易,则该元素金属性越强,反之越弱,故C正确;
D、当元素原子电子层数相同时,才可以根据最外层电子数的多少判断金属性的强弱,故D错误.
故选C.
本题解析:
本题难度:简单
2、选择题 下列排列顺序正确的是
A.热稳定性H2O>HF>H2S
B.最高正化合价F>N>C
C.酸性H2CO3>H3PO4>H2SO4
D.非金属性Cl>S>Si
参考答案:D
本题解析:试题分析:非金属性为F>O>S,所以热稳定性为HF>H2O>H2S,故A错误;F无正化合价,所以最高正化合价为N>C>F,故B错误;酸性为H2SO4F>H3PO4>H2CO3,故C正确;非金属性Cl>S>Si,故D正确。
考点:元素周期律
点评:本题考查了元素周期律,该考点是高考考查的重点和热点,本题难度不大。
本题难度:简单
3、选择题 将甲、乙两种非金属的性质相比较,知道
①甲比乙容易与H2化合
②甲原子能与乙的阴离子发生氧化还原反应
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强
④与某金属反应时甲原子得电子数目比乙的多
⑤甲的单质熔、沸点比乙低能说明甲比乙的非金属性强的是
A.①④
B.③⑤
C.①②③
D.①②③④⑤
参考答案:C
本题解析:非金属性强弱的比较主要从以下几方面进行判断:(1)元素周期律,(2)最高价化合物对应的水化物的酸性来判断,(3)其氢化物的稳定性及化合条件,(4)与盐酸之间的置换反应或物质之间的置换反应,(5)反应的条件、剧烈程度和化合物的价态等等.C项正确.
本题难度:一般
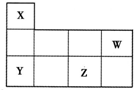
4、选择题 如图所示为元素周期表短周期的一部分,下列关于Y、Z、W的说法不正确的是( )
A.金属性:Y>Z
B.原子半径:Y>Z>W>X
C.Z的最高价氧化物对应的水化物为强酸
D.X、W两种元素可形成多种共价化合物