1、填空题 硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答:
(1)常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有___性。用玻璃棒蘸取 浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有____性。
(2)工业上用洗净的废铜屑作原料来制备硝酸铜。下列制备方法符合“绿色化学”思想的是 ___(填序号)。写出②的离子方程式:____。
①Cu+HNO3(浓)→Cu(NO3)2
②Cu+HNO3(稀)→Cu(NO3)2
③Cu CuO
CuO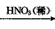 Cu(NO3)2
Cu(NO3)2
参考答案:(1)氧化;脱水
(2)③; 3Cu+8H++2NO3-==3Cu2++2NO↑+ 4H2O
本题解析:
本题难度:一般
2、填空题 写出下列反应的化学方程式
(1)铁与水蒸气高温下反应_______________ ?
(2)木炭与浓硫酸在加热条件下反应___________________
(3)氯气与熟石灰反应制漂白粉__________________
(4)石灰石与石英在高温下反应制玻璃__________________
参考答案:(1)?3Fe+4H2O Fe3O4+4H2
Fe3O4+4H2
(2)?C+2H2SO4(浓) CO2↑+2SO2↑+2H2O?
CO2↑+2SO2↑+2H2O?
(3)?2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O
(4)?SiO2+CaCO3 CaSiO3+CO2↑
CaSiO3+CO2↑
本题解析:
本题难度:一般
3、选择题 用铜和浓硫酸发生反应,下列说法中正确的是(气体体积在标准状况下测定)( )
A.若提供0.2mol硫酸,铜不足量,则可制得SO2气体2.24L
B.若提供0.2mol硫酸,铜足量,则可制得SO2气体2.24L
C.若有0.2mol硫酸参与反应,则可制得SO2气体2.24L
D.若有0.2mol硫酸被还原,则可制得SO2气体2.24L
参考答案:根据化学方程式Cu+2H2SO4(浓)═CuSO4 +SO2↑+2H2O可知,
A、若提供0.2mol硫酸,随着反应的进行,浓硫酸会变稀,稀硫酸与铜不反应,尽管铜不足量,制得SO2气体仍小于2.24L,故A错误;
B、若提供0.2mol硫酸,铜足量,随着反应的进行,浓硫酸会变稀,稀硫酸与铜不反应,则制得SO2气体小于2.24L,故B错误;
C、若有0.2mol硫酸参与反应,则可制得SO2气体2.24L,故C正确;
D、若有0.2mol硫酸被还原,则可制得SO2气体4.48L,故D错误;
故选C.
本题解析:
本题难度:简单
4、实验题 物质的制备、分离、提纯、检验是化学实验中的重要内容,利用所学知识回答下列问题:
⑴为将下列物质提纯(括号中的为杂质),应加入的试剂及采取的实验方法是
例如:食盐(泥沙) 加入试剂:水(或不填),分离方法:溶解、过滤、结晶
氧化钙(碳酸钙)加入试剂:__________,分离方法:加热
①碳酸钠固体(碳酸氢钠)加入试剂:__________,分离方法:__________
②FeCl3溶液(FeCl2) 加入试剂:__________,分离方法:__________
③SiO2(Al2O3) 加入试剂:__________,分离方法:__________
⑵实验室中为防止硫酸亚铁溶液被氧化,可采取的措施是____________________。检验硫酸亚铁溶液是否被氧化的方法是____________________。
⑶如要证明酸性:H2SO4>H2CO3>H2SiO3,在下图所示的装置分液漏斗中加入的物质的名称或化学式是:____________________。烧杯中发生反应的化学方程式是:____________________。

参考答案:⑴①加热;②氯气;③盐酸(硫酸);过滤(过滤、洗涤、干燥);
⑵加入铁粉;取少量溶液滴加硫氰化钾溶液,若溶液变为血红色,则溶液被氧化
⑶H2SO4(硫酸);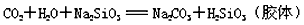
本题解析:
本题难度:一般
5、选择题 高级脂肪酸是构成脂肪的重要成分,根据氢原子的位置分为顺式脂肪酸和反式脂肪酸,天然食品所含的植物油多为顺式不饱和高级脂肪酸,常温下呈液态,不太稳定;反式脂肪酸多为固态或半固态,性质稳定,但大量摄取反式脂肪酸就有增加心血管疾病的风险甚至还会诱发肿瘤、哮喘、过敏等病状。油脂氢化过程中就有少量顺式脂肪酸转变成反式脂肪酸。下列关于高级脂肪酸的说法正确的是
A.高级脂肪酸属于高分子化合物
B.顺式脂肪酸转变成反式脂肪酸是氧化反应属于化学变化
C.氢化油脂味道比天然油脂的味道好,所以,提倡多吃奶油和“奶精”
D.油脂在碱性条件下水解生成高级脂肪酸盐的反应称为皂化反应
参考答案:D
本题解析:A 错误,高级脂肪酸不属于高分子化合物
B 错误,顺式脂肪酸转变成反式脂肪酸没有化合价的变化,不是氧化反应
C 错误,大量摄取氢化油脂,会诱发肿瘤、哮喘、过敏等病状
D 正确,油脂在碱性条件下的水解反应称为皂化反应。
本题难度:一般