1、选择题 某无色溶液,由Na+、K+、Ag+、Ba2+、Al3+、 、
、 、
、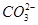 、
、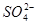 中的若干种组成。取该溶液进行如下实验:(1)取适量溶液,加入过量盐酸,有气体生成,并得到溶液;(2)在(1)所得溶液中加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;(3)在(2)所得溶液中加入过量氢氧化钡溶液,微热,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的是(?)
中的若干种组成。取该溶液进行如下实验:(1)取适量溶液,加入过量盐酸,有气体生成,并得到溶液;(2)在(1)所得溶液中加入过量的碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;(3)在(2)所得溶液中加入过量氢氧化钡溶液,微热,也有气体生成,同时析出白色沉淀乙。则下列离子在原溶液中一定存在的是(?)
A.Na+
B.Al3+
C.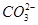
D.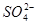
参考答案:C
本题解析:无色,说明不含 ,实验(1)说明一定有
,实验(1)说明一定有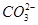 ,则必然没有Ag+、Ba2+、Al3+;实验(2)说明原来有
,则必然没有Ag+、Ba2+、Al3+;实验(2)说明原来有 ;实验(3)不能确定任何离子,因为(2)加入了过量的NH4HCO3,白色沉淀可能是BaCO3,所以正确的答案选C。
;实验(3)不能确定任何离子,因为(2)加入了过量的NH4HCO3,白色沉淀可能是BaCO3,所以正确的答案选C。
点评:该题是中等难度的试题,试题贴近高考,注重能力的培养。该题的关键是要明确进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
2、选择题 常温下,c(H+)=0.1mol?L-1的无色透明溶液中,下列各组离子一定能大量共存的是( )
A.NH4+、Mg2+、SO42-、Cl-
B.Mg2+、I-、NO3-、SO42-
C.K+、MnO4-、SO42-、Cl-
D.Na+、K+、NO3-、CO32-
参考答案:A、因该组离子在酸性条件下不反应,则离子一定能大量共存,故A正确;
B、因c(H+)=0.1mol?L-1的无色透明溶液为酸性溶液,H+、I-、NO3-能发生氧化还原反应,则离子不能大量共存,故B错误;
C、因MnO4-在水中为紫色,与无色溶液不符,故C错误;
D、因H+、CO32-能结合生成水和二氧化碳气体,则离子不能大量共存,故D错误;
故选A.
本题解析:
本题难度:一般
3、选择题 下列各组中的离子,能够大量共存于同一溶液中的是( )
A.OH-、NO3-、K+、Na+
B.H+、Ag+、Cl-、SO42-
C.K+、H+、Cl-、OH-
D.CO32-、H+、Na+、NO3-
参考答案:A、四个离子之间没有能发生反应的离子,可以共存,故A正确;
B、银离子和氯离子反应会生成氯化银沉淀,不能共存,故B错误;
C、氢离子和氢氧根离子发生反应生成水,不能共存,故C错误;
D、碳酸根离子和氢离子发生反应生成水以及二氧化碳,不能共存,故D错误.
故选A.
本题解析:
本题难度:简单
4、选择题 下列说法正确的是
A.Na2CO3溶液中c(Na+)与c(CO32—)之比为2:1
B.pH=2与pH=1的硝酸中c(H+)之比为1:10
C.0.2 mol?L-1与0.1mol/L醋酸中c(H+)之比为2:1
D.相同体积的0.1 mol?L-1盐酸和0.1mol/L醋酸分别与足量镁条反应,放出H2的体积比大于1:1
参考答案:B
本题解析:A、Na2CO3溶液中CO32-水解,溶液显碱性,则c(Na+)与c(CO32—)之比>2:1,A不正确;B、pH=2与pH=1的硝酸中c(H+)之比=10-2:10-1=1:10,B正确;C、醋酸是弱电解质,存在电离平衡。稀释促进电离,氢离子的物质的量增加,所以0.2 mol?L-1与0.1mol/L醋酸中c(H+)之比<2:1,C不正确;D、相同体积的0.1 mol?L-1盐酸和0.1mol/L醋酸的物质的量相等,且二者都是一元酸,因此与足量的镁反应产生的氢气体积相同,D不正确,答案选B。
本题难度:一般
5、选择题 下列离子方程式书写正确的是 ( )
A.盐酸滴人氨水中:H++OH-一H2O
B.过量的SO2通人NaOH溶液中:SO2+20H-=SO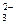 十H2O
十H2O
C.Fe(NO2)2溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++2H2O
D.硫酸亚铁溶液与稀硫酸、双氧水混合:2Fe2++H2O2+2H+=2Fe3++2H2O