1、选择题 一定能在下列无色溶液中大量共存的离子组是
[? ]
A.c(H+)=1×10-13 mol·L-1的溶液:Na+、Ba2+、HCO3-、SO42-
B.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
C.在能使紫色的石蕊试液变红的溶液中:Na+、NH4+、SO42-、Cl-
D.加入铝单质能产生大量氢气的溶液:Na+、NO3-、SO42-、Cl-
参考答案:C
本题解析:
本题难度:一般
2、选择题 已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O  ?H2SO3 + OH-?①
?H2SO3 + OH-?①
HSO3- ?H+ + SO32-?②
?H+ + SO32-?②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(HSO3-) + c(OH-) +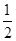 c(SO32-)
c(SO32-)
C.加入少量NaOH溶液, 、
、 的值均增大
的值均增大
D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-)
参考答案:C
本题解析:NaHSO3溶液显酸性,说明HSO3-的电离程度大于其水解。A、加入的Na与水反应生成NaOH,与HSO3-反应,故c(HSO3-)减小,错误;B、该溶液中存在电荷守恒,故c(SO32-)前的系数为2,错误;C、加入少量NaOH,c(SO32-)增大,c(HSO3-)减小,c(OH-)增大,c(H+)减小,故正确;D、c(Na+)=2c(SO32-),错误。
【考点定位】考查电解质溶液,涉及弱电解质的电离和盐类的水解、三大守恒关系的应用。
本题难度:一般
3、选择题 在无色透明的酸性溶液中能够大量共存的一组离子是( )
A.N
、Al3+、S、N
B.K+、Na+、N、S
C.K+、Mn、N、N
D.Na+、K+、HC、N
参考答案:A、在无色透明的酸性溶液中没有能发生反应的离子,能共存,且该组离子均为无色,故A正确;
B、在酸性环境下,亚硫酸根离子不能共存,故B错误;
C、高锰酸根离子是紫色的离子,与无色溶液不符,故C错误;
D、在酸性环境下,碳酸氢根离子不能共存,故D错误.
故选A.
本题解析:
本题难度:一般
4、选择题 某溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
A.Mg2+、Cl-、Na+、NO3-
B.K+、Na+、NO3-、HCO3-
C.Na+、Ba2+、Cl-、NO3-
D.Fe3+、Na+、AlO2-、SO42-
参考答案:A、碱性条件下Mg2+离子不能大量共存,故A错误;
B、在碱性或酸性条件下HCO3-离子都不能大量存在,故B错误;
C、在碱性或酸性条件下该题中四种离子都不发生任何反应,能大量共存,故C正确;
D、碱性条件下Fe3+离子不能大量共存,酸性条件下AlO2-离子不能大量存在,且Fe3+与AlO2-离子发生相互促进的水解而不能大量共存,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列离子或分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是(?)
A.K+、Na+、NO3-、SiO32-
B.Al3+、K+、SO42-、S2-
C.Ag+、Na+、NH3·H2O、NO3-
D.Cu2+、Fe2+、Cl-、SO42-
参考答案:D
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。A中离子可以大量共存,但通入NO2后,NO2与水反应生成硝酸,硝酸与SiO32-反应生成硅酸沉淀,不符合题意;B中Al3+与S2-不能大量共存,二者反应生成氢氧化铝沉淀和H2S气体,不符合题意;C中Ag+与NH3·H2O不能大量共存,二者反应可以生成白色沉淀氢氧化银,不符合题意;D中离子可以大量共存,但通入NO2后,NO2与水反应生成硝酸,硝酸具有强氧化性,能把Fe2+氧化生成铁离子,没有沉淀。符合题意,答案选D。
本题难度:一般