1、选择题 三种元素的微粒Xn-、Y8+、zn+都有相同的电子层结构,已知n>p,则它们核内质子数(依次用X′、Y′、Z′表示)的关系为
A.X′="Y′=Z′"
B.Y′> Z′>X′
C.X′> Z′> Y′
D.Z′= Y′>X′
参考答案:B
本题解析:
本题难度:困难
2、选择题 金属的下列性质中,不能用金属晶体结构加以解释的是?
A.易导电
B.易导热
C.有延展性
D.易锈蚀
参考答案:D
本题解析:试题分析:金属晶体是由金属阳离子和自由电子构成的,二者之间存在金属键。由于金属键的存在,使金属易导电、导热、有延展性。而金属的易腐蚀与金属的活泼性相关,答案选D。
考点:考查金属晶体的结构、性质
点评:本题是常识性知识的考查,难度不大。主要是考查学生对基础知识的熟悉掌握程度,不难得分。
本题难度:简单
3、选择题 运用元素周期律分析以下说法,其中正确的是
A.原子半径:K>Na>Al
B.非金属性:N>O>F
C.稳定性:HFD.碱性:NaOH
参考答案:A
本题解析:
本题难度:困难
4、选择题 下列气态氢化物最稳定的是
A.HF
B.NH3
C.H2O
D.HI
参考答案:A
本题解析:试题分析:非金属性越强,氢化物的稳定性越强,F是最活泼的非金属,HF是最稳定的,答案选A。
考点:考查元素周期律的应用
点评:元素的性质随着原子序数的递增呈现周期性的变化,称为元素周期律。关于元素周期律需要熟练记住,并能灵活运用。
本题难度:困难
5、选择题 下列化合物中不含离子键的是
A.(NH4)2S
B.Al2(SO4)3
C.CsOH
D.HNO3
参考答案:D
本题解析:(NH4)2S和Al2(SO4)3都是盐,CsOH是强碱,它们都是离子化合物,都含离子键。
HNO3属于酸,HNO3溶于水也能电离出H+和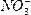 ,但HNO3是共价化合物,分子中不含离子键。
,但HNO3是共价化合物,分子中不含离子键。
本题难度:简单