1、选择题 对于反应KMnO4+HCl-KC1+MnCl2+Cl2+H2O(未配平),若有0.1mol?KMnO4?参加反应,下列说法不正确的是
A.转移0.5?mol电子
B.氧化产物与还原产物之比为5:2
C.参加反应的HC1为0.8?mol
D.氧化剂与还原剂之比为1:8
参考答案:D
本题解析:分析:根据氧化还原反应中氧化剂和还原剂得失电子数目相等可知反应的方程式为2KMnO4+16HCl=2KC1+2MnCl2+5Cl2+8H2O,根据元素化合价的变化判断氧化剂和还原剂以及电子转移的数目.
解答:配平后的反应的方程式为2KMnO4+16HCl=2KC1+2MnCl2+5Cl2+8H2O,若有0.1molKMnO4?参加反应,则
A.转移电子的物质的量为0.1mol×(7-2)=0.5mol,故A正确;
B.氧化产物为Cl2,还原产物为MnCl2,物质的量之比为5:2,故B正确;
C.由方程式可知,若有0.1molKMnO4?参加反应,应有0.8molHCl参加反应,故C正确;
D.若有0.1molKMnO4?参加反应,有0.8molHCl参加反应,其中有0.5molHCl被氧化,氧化剂与还原剂之比为1:5,故D错误.
故选D.
点评:本题考查氧化还原反应,题目难度中等,先配平反应的化学方程式为解答该题的关键,注意氧化剂和还原剂等概念的判断.
本题难度:困难
2、选择题 1.在人工合成中掺入放射性14C的用途是2.以上所述人工合成的牛胰岛素与天然结晶是同一物质的依据是
A.催化剂
B.媒介质
C.组成元素
D.示踪原子
E.扩散作用
F.渗透作用
G.相似相溶作用
H.物质结构相同
参考答案:1. D
2. D
本题解析:1.试题分析:放射性14C的主要用途是做示踪原子,答案选D。
考点:考查14C用途的有关判断
点评:该题是常识性知识的考查,学生只要记住即可,难度不大。
2.试题分析:由于得到了放射性14C分布均匀的结晶物,这说明人工合成的牛胰岛素与天然结晶的物质结构是相同的,因此属于同一种物质,答案选D。
考点:考查有机物结构的判断
点评:该题是基础性试题的考查,该题的关键是明确14C在测定有机物结构方面的重要作用,从而得出两种物质的结构相同。该题有利于培养学生的逻辑思维能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:一般
3、选择题 已知某氨基酸的相对分子质量小于200,且氧的质量分数约为0.5,则其分子中碳的个数最多为
A.5个
B.6个
C.7个
D.8个
参考答案:B
本题解析:试题分析:每个羧基含有2个O原子,则:
含羧
基数
氧所占相
对原子质量
氨基酸相对分子质量
氨基占相对原子质量
碳原子约所占相对原子质量
最多可
含碳数
是否合理
1
32
64
16
14
1
不合理
2
64
128
16
48
4
合理
3
96
192
16
80
6
合理
当羧基数目为4,氨基酸的相对分子质量为256,大于200,不符合题意,故该氨基酸最多含有6个原子,答案选B。
考点:考查氨基酸的结构、分子式的确定
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,针对性强,旨在培养学生分析、归纳和总结问题的能力,有利于培养学生的逻辑推理能力和抽象思维能力。依据数学知识讨论分子中含羧基的数目是解题的关键。
本题难度:一般
4、选择题 下列离子方程式与所述事实相符且正确的是
A.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑
B.用双氧水和稀硫酸处理铜板:Cu+H2O2+2H+=Cu2++2H2O
C.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
D.铵明矾[AlNH4(SO4)2?12H2O]溶液中加入过量氢氧化钡溶液:Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O
参考答案:BD
本题解析:分析:A.发生氧化还原反应生成NaOH和氧气,水既不是氧化剂也不是还原剂;
B.发生氧化还原反应生成硫酸铜和水;
C.反应生成碳酸钙和HClO;
D.[AlNH4(SO4)2?12H2O]完全反应.
解答:A.H218O中投入Na2O2固体的离子反应为2H218O+2Na2O2=418OH-+O2↑4Na+,故A错误;
B.用双氧水和稀硫酸处理铜板的离子反应为Cu+H2O2+2H+=Cu2++2H2O,故B正确;
C.漂白粉溶液在空气中失效的离子反应为Ca2++2ClO-+CO2+H2O=2HClO+CaCO3↓,故C错误;
D.铵明矾[AlNH4(SO4)2?12H2O]溶液中加入过量氢氧化钡溶液的离子反应为Al3++NH4++2SO42-+2Ba2++5OH-=AlO2-+2BaSO4↓+NH3?H2O+2H2O,故D正确;
故选BD.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意反应的实质,选项A中的氧化还原及D中与量有关的离子反应为解答的难点,题目难度中等.
本题难度:一般
5、选择题 将15g两种金属的混合物与足量的稀H2SO4反应后得到标准状况下的氢气11.2L,则这两种金属不可能是
A.Mg和Al
B.Mg和Fe
C.Al和Fe
D.Al和Cu
参考答案:A
本题解析:分析:假设金属都为+2价,根据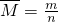 计算金属混合物的平衡相对原子质量,利用平均值法判断.
计算金属混合物的平衡相对原子质量,利用平均值法判断.
解答:11.2L氢气的物质的量为: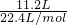 =0.5mol,
=0.5mol,
假设金属都为+2价,则金属混合物的平均相对原子质量为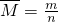 =
= =30,
=30,
A、Mg的相对原子质量为24,当Al的化合价为+2价时,可看成其相对原子质量为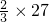 =18,二者都小于30,平均值不可能为30,故A错误;
=18,二者都小于30,平均值不可能为30,故A错误;
B、Mg的相对原子质量为24,Fe的相对原子质量为56,平均值可能为30,故B正确;
C、当Al的化合价为+2价时,可看成其相对原子质量为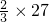 =18,Fe的相对原子质量为56,平均值可能为30,故C正确;
=18,Fe的相对原子质量为56,平均值可能为30,故C正确;
D、当Al的化合价为+2价时,可看成其相对原子质量为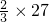 =18,Cu与稀硫酸不反应,当Al的质量为9g时,可生成11.2L氢气,符合题意,故D正确.
=18,Cu与稀硫酸不反应,当Al的质量为9g时,可生成11.2L氢气,符合题意,故D正确.
故选A.
点评:本题考查混合物的计算,题目难度中等,本题利用平均值法计算,注意化合价与相对原子质量的关系.
本题难度:困难