1、选择题 一定条件下反应A2(g)+B2(g) 2AB(g)达到平衡状态的标志是 (?)?
2AB(g)达到平衡状态的标志是 (?)?
A.2υ(正、A2)=υ(逆、AB)
B.容器内的总压强不随时间而变化
C.单位时间内生成n mol AB的同时,生成n mol的B2
D.A2、B2、AB的反应速率比为2:2:1的状态
参考答案:A
本题解析:在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的方向相反,且满足反应速率之比是相应的化学计量数之比,可以说明反应达到平衡状态;该反应是体积不变的可逆反应,所以容器内气体的压强始终是不变的,B不正确;C中反应速率的方向相同,速率之比是相应的化学计量数之比,因此C中的关系始终是成立,不正确。平衡时各种物质的浓度不再发生变化,但各种的浓度之间不一定满足某种关系,D不能说明,答案选A。
点评:该题是中等难度的试题,也是高考中的常见题型和考点。试题基础性强,难易适中,侧重对学生能力的培养和解题方法的指导与训练,有助于培养学生的逻辑推理能力和发散思维能力。该题的关键是明确平衡状态的特点,然后结合具体的可逆反应灵活运用即可。
本题难度:简单
2、选择题 在一个容积为V?L的密闭容器中,放入2?L?A(g)和1?L?B(g),在一定条件下发生下列反应:3A(g)+B(g) nC(g)+2D(g).达到平衡后,A物质的量浓度减小1/2,混合气的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g).达到平衡后,A物质的量浓度减小1/2,混合气的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
[? ]
A.1
B.2
C.3? ?
D.4
参考答案:A
本题解析:
本题难度:一般
3、计算题 在一定温度下将100mLN2,H2混合气充入密闭恒压容器内,发生反应达到平衡时维持温度不变,测得混合气的密度是反应前密度的1.25倍,平均分子量为15.5。求平衡时N2的转化率;N2,H2两种气体开始时各为多少毫升?
参考答案:平衡时N2的转化率25%;N2,H2两种气体开始的体积分别为40mL和60mL。
本题解析:∵同T同P下有(ρ1/ρ2)=(m1/m2)

∴有(1/1.25)=(m1/15.5)?解得m1=12.4
(V1/V2)=(n1/n2)
即:?VN2∶VH2=10.4∶15.6
∴?VN2=10.4/(10.4+15.6)×100mL=40mL
?VH2=100mL-40mL=60mL
设N2转化的体积为x,则有:
?N2? + ?3H2 2NH3
2NH3
起始体积 40 60 0
转化体积 x 3x 2x
平衡体积 40-x 60-3x 2x
?V总=40-x+60-3x+2x=100-2x
∴有:
15.5=((40-x)×28+(60-3x)×2+2x×17)/(100-2x)
解得?x=10mL
∴N2的转化率为:
N2%=(10/40)×100%=25%
本题难度:简单
4、填空题 ( 10分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。已知:CO(g) + H2O(g) H2(g) + CO2(g)? △H= a kJ·mol-1?的平衡常数随温度的变化如下表:
H2(g) + CO2(g)? △H= a kJ·mol-1?的平衡常数随温度的变化如下表:
(1)上述正反应方向是?反应(填“放热”或“吸热”)。
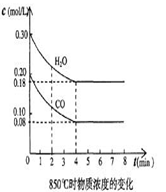
t1℃时物质浓度(mol/L)的变化
 ?
?
时间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c2
| c3
| c3
|
4
| c1
| c2
| c3
| c3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
|
?
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量?(填增大、减小或不变)。
②表中3 min~4 min之间反应处于?状态;CO的体积分数?16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气? B.降低温度? C.使用催化剂? D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为?。
参考答案:1)放热(2)①不变?②化学平衡?大于?③D? A(3)75%
本题解析:(1)题随着温度的升高,平衡常数在降低,说明该反应的正反应是放热反应。
(2)①密闭容器中混合气体的平均摩尔质量=混合气体的总质量÷总的物质的量,由于是在密闭容器中,2min时和3min时混合气体的总质量不变,而且该反应是一个等体积反应及以2min时和3min时混合气体的总的物质的量也不变,所以与2min时相比,3min时密闭容器中混合气体的平均摩尔质量不变。②表中3 min和4 min时反应物和生成物的浓度均没有发生变化,所以3 min~4 min之间反应处于化学平衡状态,CO的体积分数的体积分数大于16%。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是升高了温度,增加了生成物的浓度,故选D,表中5 min~6 min之间,生成物的浓度在增加,平衡向正反应方向移动,同时水蒸气的浓度也在增加,故可能的原因是增加了水蒸气的量,选A.
(3)题反应在500℃时进行时平衡常数是9,设达到平衡时H2的物质的量为X,此时可解得X=0.005,所以CO的转化率为75%
点评:本题重在考查化学平衡的移动,考查的知识点都是平常所见的,属于中等难度的题,学生需要对图像进行分析,注意图像中的横纵坐标,以及曲线的变化趋势,以及特殊点。本题涉及的平衡的计算难度不高
本题难度:困难
5、选择题 一定条件下存在反应:CO(g)+H2O(g)?CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1mol CO和1mol H2O,在Ⅱ中充入1mol CO2和1mol H2,在Ⅲ中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
A.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ、Ⅱ中正反应速率相同
D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1
参考答案:A
本题解析:A.根据题意可知:密闭容器Ⅰ、Ⅱ是在正逆两个相反的方向开始的反应,由于正反应是放热反应,所以逆反应就是吸热反应,所以因为装置与外界绝热,所以根据平衡移动原理:升高温度,平衡向吸热反应方向移动,因此容器Ⅰ的平衡转化率比容器Ⅱ小,所以容器Ⅰ中CO 的物质的量比容器Ⅱ中的多,正确;B.容器Ⅰ、Ⅲ中反应由于温度不同,所以反应的平衡常数不相同,错误;C.由于容器Ⅰ反应发生后温度升高,而Ⅱ中反应发生后温度降低,所以温度不同,它们的化学反应的正反应速率不相同,错误;D.若反应是在相同温度下进行,容器Ⅰ中CO 的转化率与容器Ⅱ中CO2的转化率之和等于1,但是反应是在绝热下进行,所以二者的CO2的转化率之和小于1,错误。
本题难度:一般