1、选择题 某温度下在密闭容器中发生如下反应:2SO2(g)+O2(g) 2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:
2SO3(g),若开始时只充入2 molSO3,达到平衡时,混合气体的压强比起始时增大了10%;若开始时只充入了2 mol SO2和1 molO2的混合气体,达到平衡时SO2的转化率为:
A.10%
B.60%
C.80%
D.90%
参考答案:C
本题解析:题目中两次投料为等效平衡,所以第一次投料SO3的转化率和第二次投料SO2的转化率之和为1。根据方程式,当?2SO3?完全反应时气体压强增大50%,现增大10%,所以消耗SO30.4 mol ,转化率为20%,故SO2的转化率为1—20%=80%。
本题难度:一般
2、选择题 mA(g)+nB(g)  pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图2-32中实线所示,有关叙述正确的是?(?)
pC(g)(正反应为放热反应)的可逆反应,在恒温条件下,平衡时B在混合物中的含量(B%)与压强的关系如图2-32中实线所示,有关叙述正确的是?(?)
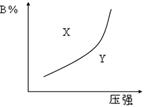
A.m+n> p
B.x点的速率关系为v正>v逆
C.n>p
D.x点比y点混合物反应速率快
参考答案:B
本题解析:略
本题难度:简单
3、填空题 (10分)向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题:
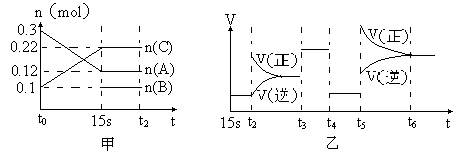
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为?。
(2)乙图中t2时引起平衡移动的条件是?,t5时引起平衡移动的条件是?。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是?。
(4)该反应的化学方程式可以表示为:?,正反应为?(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为?。
参考答案:(1)? 0.004? mol/Ls?(2分)。
(2)?增加A的浓度,升高温度。(3)t5——t6。(每空1分)
(4) 3A(g) B(g)+2C(g),(2分)吸热(1分)
B(g)+2C(g),(2分)吸热(1分)
(5)0.04mol(2分)
本题解析:略
本题难度:一般
4、填空题 (14分)(2012?重庆)尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
(1)工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为?.
(2)当氨碳比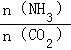 =4时,CO2的转化率随时间的变化关系如图1所示.
=4时,CO2的转化率随时间的变化关系如图1所示.
①A点的逆反应速率v逆(CO2)?B点的正反应速率v正(CO2)(填“大于”“小于”或“等于”).
②NH3的平衡转化率为?.
(3)人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如图2所示.
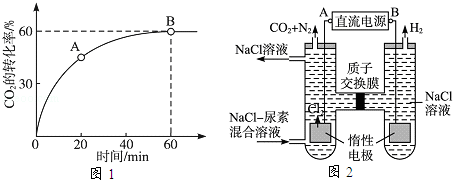
①电源的负极为?(填“A”或“B”).
②阳极室中发生的反应依次为?、?.
③电解结束后,阴极室溶液的pH与电解前相比将?;若两极共收集到气体13.44L(标准状况),则除去的尿素为??g(忽略气体的溶解).
参考答案:(1)2NH3+CO2 CO(NH2)2+H2O;
CO(NH2)2+H2O;
(2)①小于②30%
(3)①B②6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl③ 不变,7.2
本题解析:(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,配平书写方程式;
(2)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为0.6a,根据方程式计算转化的NH3的物质的量,再根据转化率定义计算;
(3)①根据电解池中阴离子在阳极放电和阳离子在阴极放电的规律,结合本题图中的电极产物H2和Cl2可以判断出A为电源的正极,B为电源的负极;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl;
③阴极反应为:6H2O+6e﹣═6OH﹣+3H2↑(或6H++6e﹣═3H2↑)
阳极反应为:6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH﹣、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH﹣恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6 mol e﹣时,阴极产生3 mol H2,阳极产生1 mol N2和1 mol CO2,根据n=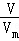 计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.
计算两极产生的气体的物质的量,利用气体中各组分的比例关系,计算n(N2)=n(CO2),再根据方程式计算尿素的物质的量,根据m=nM计算尿素的质量.
解:(1)CO2和NH3合成CO(NH2)2,根据元素守恒可知,同时还有H2O生成,化学方程式为:
2NH3+CO2 CO(NH2)2+H2O,故答案为:2NH3+CO2
CO(NH2)2+H2O,故答案为:2NH3+CO2 CO(NH2)2+H2O;
CO(NH2)2+H2O;
(2)①由CO2的转化率随时间变化图可知在A点时反应还未达到平衡状态,反应仍将继续正向进行,故v逆(CO2)小于B点平衡时的化学反应速率,故答案为:小于;
②设CO2的初始物质的量为a,则NH3的初始物质的量为4a,由图可知,CO2的转化率为60%,故转化的二氧化碳为a×60%=0.6a,根据方程式可知,转化的NH3的物质的量为0.6a×2=1.2a,故平衡时氨气的转化率定为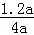 ×100%=30%,
×100%=30%,
故答案为:30%;
(3)①由图可知,左室电极产物为Cl2,发生氧化反应,故A为电源的正极,右室电解产物H2,发生还原反应,故B为电源
的负极,故答案为:B;
②由图可知,阳极室首先是氯离子放电生成氯气,氯气再氧化尿素生成氮气、二氧化碳,同时会生成HCl,阳极室中发生的反应依次为:6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl,
故答案为:6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl;
③阴极反应为6H2O+6e﹣═6OH﹣+3H2↑(或6H++6e﹣═3H2↑)
阳极反应为6Cl﹣﹣6e﹣═3Cl2↑,CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
根据上述反应式可以看出在阴、阳极上产生的OH﹣、H+的数目相等,阳极室中反应产生的H+通过质子交换膜进入阴极室与OH﹣恰好反应生成水,所以阴极室中电解前后溶液的pH不变;
由上述反应式可以看出,转移6 mol e﹣时,阴极产生3 mol H2,阳极产生1 mol N2和1 mol CO2,故电解收集到的13.44 L气体,物质的量为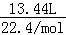 =0.6mol,即n(N2)=n(CO2)=0.6mol×
=0.6mol,即n(N2)=n(CO2)=0.6mol× ="0.12" mol,
="0.12" mol,
根据方程式CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl可知生成0.12 mol N2所消耗的CO(NH2)2的物质的量也为0.12 mol,其质量为:m[CO(NH2)2]="0.12" mol×60 g?mol﹣1="7.2" g,
故答案为:不变,7.2;
点评:考查化学平衡的计算、电解池原理与有关计算,难度较大,(3)中关键注意观察电极产物,判断发生的反应,注意根据方程式判断左室中PH值的变化.
本题难度:一般
5、填空题 右图表示800℃时,A、B、C三种气体物质的浓度随时间变化的情况,t是达到平衡状态的时间。试回答:
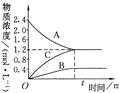
(1)该反应的反应物是?。
(2)该反应的化学方程式是:?。
(3)若达到平衡状态的时间为2min,则A的平均速率是?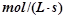 。
。
参考答案:(1)A?(2)3A 3C + B? (3)0.01
3C + B? (3)0.01
本题解析:(1)根据图像可知,A物质的浓度降低,所以A物质是反应物。
(2)平衡时A的浓度减少了2.4mol/L-1.2mol/L=1.2mol/L,B和C的浓度分别增加了0.4mol? /L和
1.2mol/L,则根据浓度的变化量之比是相应的化学计量数之比可知,反应的化学方程式是3A 3C + B。
3C + B。
(3)反应速率通常用单位时间内浓度的变化量来表示,则A的平均速率是1.2mol/L÷2min=0.6mol/(L·min)。
点评:该题是中等难度的试题,试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养。有利于调动学生的学习兴趣,提高学生应试能力和学习效率。该题的关键是在明确图像中曲线变化的基础上,灵活运用即可。
本题难度:一般