1、选择题 利用下列实验装置完成相应的实验,能达到实验目的是
A.①检验溶液中是否含有KCl
B.②除去乙酸中溶有的少量乙醇
C.③分离酒精与水的混合物
D.④用Cu和浓硫酸制备SO2
参考答案:C
本题解析:分析:A.检验钾离子应通过蓝色钴玻璃;
B.乙酸和乙醇混溶,不能用分液的方法分离;
C.酒精和水的沸点不同,可用蒸馏的方法分离;
D.二氧化硫的密度比空气大,应用向上排空法收集.
解答:A.检验钾离子应通过蓝色钴玻璃,否则不能观察到颜色,故A错误;
B.乙酸和乙醇混溶,不能用分液的方法分离,应用蒸馏法分离,故B错误;
C.酒精和水的沸点不同,可用蒸馏的方法分离,可在溶液中加来源:91考试网 91ExaM.org入少量生石灰,故C正确;
D.二氧化硫的密度比空气大,应用向上排空法收集,且尾气吸收装置不能将导管直接插入到液面以下,故D错误.
故选C.
点评:本题考查物质的分离和提纯,综合考查学生实验能力,注意把握物质的性质的异同,题目难度不大.
本题难度:简单
2、填空题 元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价:
元素代号
| A
| B
| C
| D
| E
|
原子半径/nm
| 0.16
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6,-2
| +2
| -2
|
?
(1)在下表中标出上述五种元素在元素周期表中的对应位置(用元素符号)。
(2)在下表中标明通常寻找催化剂材料的区域(用斜线阴影)。
(3)A、B、E三种元素各自形成简单离子,其中半径最大的为________(填离子符号)。
(4)证明B元素的单质与A元素的单质在化学性质上有明显不同的离子方程式为:________________________。
(5)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,请写出D的氧化物与强碱溶液反应的离子方程式:________________________。
参考答案:(1)
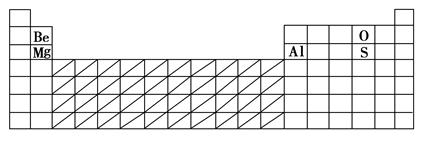
(2)见上表 (3)O2-
(4)2Al+2OH-+2H2O=2AlO2-+3H2↑
(5)BeO+2OH-=BeO22-+H2O
本题解析:(1)根据表格提供数据,可以推断D为Be,A为Mg,E为O,C为S,B为Al。(2)根据元素周期律,在过渡元素区域寻找催化剂材料。(3)根据具有相同电子层结构的不同微粒,核电荷数越大,微粒半径越小,Mg2+、Al3+、O2-中半径最大的为O2-。(4)Al与Mg在化学性质上明显不同的是Al能与强碱溶液反应。
本题难度:简单
3、选择题 能够用分液漏斗进行分离的一组混合物是
A.氯化钠溶液和泥沙
B.乙醇和水
C.四氯化碳和碘
D.苯和水
参考答案:D
本题解析:分液漏斗是用来分离两种互不相溶的液体。故只有苯和水可以。
本题难度:困难
4、填空题 (5分)用“>”或“<”填空:
(1)酸性:H2CO3___________H2SiO3,H2SiO3___________H3PO4。
(2)碱性:Ca(OH)2___________Ba(OH)2,Mg(OH)2___________Al(OH)3
(3)气态氢化物稳定性:NH3___________ H2O, H2S ___________ HCl
(4)还原性:HCl ___________HBr,H2S___________HCl
(5)酸性:H2SO4___________H2SO3,HClO ___________ HClO4
参考答案:①>< ②<>③<<? ④ <>? ⑤><
本题解析:根据元素周期律同周期由左向右金属性逐渐减弱,非金属性逐渐增强,形成的最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强、同主族由上到下金属性逐渐增强,非金属性逐渐减弱,形成的最高价氧化物对应的水化物碱性逐渐增强,酸性逐渐减弱,氢化物越来越不稳定,C、Si,Ca、Ba分别同主族,Si、P、Al、Mg、S、Cl,N、O,分别同周期,⑴⑵⑶⑷见答案,⑸H2SO4、HClO4为强酸,H2SO3为中强酸,HClO为弱酸。
本题难度:一般
5、选择题 A、B两元素可形成AB型离子化合物,如果A、B两种离子的核外电子数之和为20,则A、B两元素所处的周期为(? )
A.在同一周期
B.一种在第一周期,一种在第二周期
C.一种在第二周期,一种在第三周期
D.一种在第三周期,一种在第四周期
参考答案:C
本题解析:略
本题难度:简单