| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《化学反应与能量》考点强化练习(2017年押题版)(十)
参考答案:B 本题解析:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的能量。A不正确,氢对应的是液态水。1mol氧气得到4mol电子,所以选项B正确。△H和方程式的计量数及物质的状态有关系,C不正确。形成4 mol碳氧共用电子对,说明CO2是1mol,所以D是错误的。答案选B。 本题难度:一般 4、简答题 (15分) |
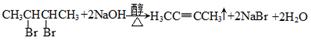 (3)已知在常温常压下:
(3)已知在常温常压下:

参考答案:(15分)
(1)极性(2分)
(2)60%(2分) CF(2分,全对得2分,只选1个且正确的得1分,选错1个扣1分,扣完为止)
(3)(b-a-4c)/2(3分)
(4)CH3OH-6e-+8OH-=CO32-+6H2O(3分) 3.2g(3分,数值正确、未写单位的扣1分)
本题解析: (1) 甲醇分子的正负电荷重心不重合,所以甲醇是极性分子;
(2)①:设消耗CO的物质的量为xmol,则CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
开始时(mol) 1 2 0
消耗(mol) x 2x x
平衡时(mol)1-x 2-2x x
根据题意可得1-x+2-2x+x=3/5(1+2)
解得x=0.6
所以CO的转化率为0.6mol/1mol×100%=60%
②A、未指明正逆反应且比例关系不符合化学计量数之比,错误;B、CO的消耗速率等于CH3OH的生成速率,均是正反应速率,未达平衡也符合,错误;C、恒容条件下,该反应的气体压强开始时一直减小,达平衡时不再变化,正确;D、恒容条件下,气体的总质量不变,所以气体的密度始终不变,错误;E、该反应中的气体均无色,错误;F、气体的总质量不变,物质的量在减小,混合气体的平均相对分子质量在减小,达平衡时,混合气体的平均相对分子质量不再变化,正确,答案选CF。
(3)根据盖斯定律,目标方程式=1/2(①-②)+2×③,所以△H=1/2(b-a)-2c=(b-a-4c)/2;
(4)①燃料电池的负极是燃料发生氧化反应,结合电解质溶液,所以负极的电极反应式为
CH3OH-6e-+8OH-=CO32-+6H2O
②溶液中各离子的物质的量分别为:n(Cu2+)=0.1mol,n(Cl-)=0.4mol,电解开始时,阳极是氯离子放电生成氯气2Cl---2e-=Cl2↑,阴极是Cu2++2e-==Cu,当0.1molCu2+放电完毕后H+放电2H++2e-==H2↑,此时阳极生成0.1mol氯气;随后阴极和阳极产生的氢气和氯气的物质的量相等,只有氯离子放电完毕后,才有可能两极产生的气体体积相等。当氯离子放电完毕,OH-开始放电时两极产生的气体的物质的量分别是阳极:Cl2 0.2mol,阴极:H2 0.1mol;设当生成O2xmol时两极产生的气体相等,则阴极又产生H22xmol,所以0.2+x=0.1+2x,解得x=0.1mol,所以氧气得质量为3.2g;
考点:考查分子极性的判断,化学平衡的计算,盖斯定律的应用, 电化学原理的应用
本题难度:困难
5、选择题 下列现象能用键能大小解释的是
A.稀有气体一般很难发生化学反应
B.常温常压下,溴呈液态
C.氮气的化学性质比氧气稳定
D.硝酸容易挥发,而硫酸很难挥发
参考答案:C
本题解析:A项中主要是原子最外层达到了稳定结构;B项是由于分子间作用力较大才使溴变了为液态;C是正确的;D是由于硝酸中存在分子内氢键使得其沸点比较低,不是键能的原因;
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的分类.. | |