1、填空题 硫通常是一种淡黄色的晶体。有橙色、无色、红棕色三种颜色的硫蒸气,它们都是硫的单质,但每个分子中硫原子的个数不同,可用Sx表示。对这三种硫蒸气测定的结果是:①橙色蒸气的密度折算成标准状况后是11.43g·L-1,则它的化学式是?;②红棕色蒸气的质量是相同状况时同体积空气的6.62倍,则它的化学式为?;③无色蒸气对氢气的相对密度是64,则它的化学式是?。此事实说明:硫有?。
参考答案:S8? S6? S4?多种同素异形体
本题解析:硫有多种同素异形体,本题可依据不同的方法求算这些单质的摩尔质量。①M=ρVm=11.43g·L-1×22.4L·mol-1≈256g·mol-1,故其化学式为S8;?②M=6.62×29g·mol-1≈192g·mol-1,故该单质的化学式为S6;?③M=64×2g·mol-1=128g·mol-1,故该单质的化学式为S4。
本题难度:简单
2、选择题 常温下,可以用铝或铁制容器贮存浓H2SO4,下列叙述正确的是(? )
A.常温下,浓H2SO4与铁、铝不反应
B.贮存浓H2SO4的器皿可敞口,因为浓H2SO4难挥发
C.贮存浓H2SO4的容器应远离热源
D.常温下,浓H2SO4与氧化铝、氧化铁不能反应
参考答案:C
本题解析:常温下,之所以能用铝或铁制容器来贮存浓H2SO4,是因为Fe、Al在常温下被浓硫酸钝化,表面生成一种致密的保护膜。这并不意味着浓H2SO4与Fe、Al不反应,而是反应后又立即停止。在加热的情况下,Fe、Al会跟浓H2SO4剧烈反应,生成硫酸盐、SO2、H2O。贮存浓H2SO4的容器不可敞口,浓H2SO4虽难挥发,但易吸水而变稀。常温下,浓H2SO4与Al2O3、Fe2O3会发生反应生成Al2(SO4)3、Fe2(SO4)3和H2O。
本题难度:简单
3、选择题 银耳本身为淡黄色,少数不法分子生产一种“雪耳”,颜色洁白如雪,其制作过程如下:将银耳堆放在密闭状况良好的塑料棚内,在棚的一端支一口锅,锅内放硫黄,加热使硫熔化并燃烧,两天左右,“雪耳”就制成了,“雪耳”炖不烂,且对人有害,制作“雪耳”利用的是
[? ]
A.硫的还原性
B.硫的漂白性
C.二氧化硫的还原性
D.二氧化硫的漂白性
参考答案:D
本题解析:
本题难度:简单
4、选择题 在下图所示的实验装置中,实验进行一段时间后,对观察到的现象叙述不正确的是( ? )
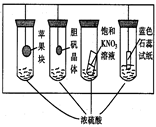
A.苹果块会干瘪
B.胆矾晶体表面有“白斑”
C.小试管内有KNO3晶体析出
D.蓝色石蕊试纸变红
参考答案:D
本题解析:浓硫酸具有脱水性、吸水性和强氧化性,因此选项ABC都是正确的,D中蓝色石蕊试纸应该是先变红后变黑,答案选D。
点评:该题是高考中的常见考点,属于中等难度的试题。试题基础性强,主要是检验学生对浓硫酸性质的酸性掌握程度,以及灵活运用浓硫酸的性质解决实际问题的能力,有利于培养学生的逻辑思维能力和发散思维能力。
本题难度:简单
5、选择题 常温下,由下列实验事实得出结论错误的是
A.SO2使高锰酸钾溶液褪色,说明SO2具有漂白性
B.不小心将浓硫酸溅到手上,应立即用大量的水冲洗
C.常温下浓硫酸可以用铝罐储存,说明铝能在冷的浓硫酸中钝化
D.蔗糖加入浓硫酸后变黑,说明浓硫酸具有脱水性
参考答案:A
本题解析:SO2使高锰酸钾溶液褪色,是因为SO2有还原性将高锰酸钾还原而使其褪色,A错;B正确(有些教材如人教版:不小心将浓硫酸溅到手上,应先用布擦,再用水冲洗,);铁铝均可被浓硫酸钝化,因此可以用铝罐储存浓硫酸,C正确;浓硫酸具有脱水性,将蔗糖中的氢氧原子按2:1的比脱去,:D正确。
本题难度:一般