1、选择题 下表中元素均为中学化学中常见短周期元素,根据表中信息,下列说法不正确的是
A.X 与W形成的化合物是共价化合物
B.常温下单质与水反应速率:X > N
C.最高价氧化物对应水化物酸性:W > Z
D.X和Y的单质在一定条件下反应可生成一种淡黄色的固体化合物
参考答案:A
本题解析:根据化学价和原子半径可以推知各元素,Y只有-2价,为O元素;Z有-2、+6两种价态,为S元素;W有+7、-1两种价态为Cl(第ⅦA族的F只有-1价);X为+1价且原子半径比S、Cl原子半径大,所以应为Na;N为+2价,原子半径比Na小,所以应为Mg。
Na与Cl形成的NaCl是离子化合物,故A错;常温下,Na比Mg活泼,其单质与水反应更剧烈,所以B正确;Cl比S非金属性强,其最高价氧化物水化物酸性也更强,即HClO4酸性强于H2SO4,故C正确;Na与O2在加热条件下可以生产淡黄色的固态Na2O2,故D正确。
本题难度:困难
2、选择题 盛放在敞口容器中的下列溶液,久置后溶液中原溶质的浓度会变大的是
A.浓硫酸
B.浓氢氧化钠
C.氯水
D.氯化钠
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列分子或离子的空间构型为平面三角形的是
A.SiH4
B.H3O+
C.SO32-
D.NO3-
参考答案:D
本题解析:试题分析:立体构型为平面三角形的分子应含有3个δ键,且没有孤对电子,中心原子为sp2杂化,据此将进行解答。A、Si原子形成4个δ键,根据价层电子对互斥理论可知孤对电子数=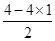 =0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=
=0,所以为sp3杂化,立体构型为正四面体,因此A不选;B、O原子形成3个δ键,孤对电子数=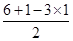 =1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故B不选;C、S原子形成3个δ键,孤对电子数=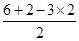 =1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=
=1,所以为sp3杂化,立体构型为三角锥型,故C不选;D、N原子形成3个δ键,孤对电子数=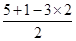 =0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
=0,所以中心原子为sp2杂化,立体构型为平面三角形,故D正确,答案选D。
考点:考查分子空间构型的判断
本题难度:困难
4、选择题 只用一种试剂(可加热)就能鉴别出NH4Cl、Na2SO4、(NH4)2CO3、三种溶液,应选用
A.BaCl2
B.HCl
C.NaOH
D.Ba(OH)2
参考答案:D
本题解析:分析:检验铵根离子一般利用碱,检验硫酸根离子一般利用钡离子,则选项氢氧化钡可鉴别,以此来解答.
解答:A、BaCl2溶液与(NH4)2CO3、Na2SO4溶液反应均生成白色沉淀,则无法鉴别,故A错误;
B、盐酸只与(NH4)2CO3反应生成气体,与另两种物质不反应,则不能鉴别,故B错误;
C、氢氧化钠溶液与(NH4)2CO3、NH4Cl溶液反应均生成气体,则无法鉴别,故C错误;
D、Ba(OH)2溶液与NH4Cl反应有气体生成,与Na2SO4溶液反应有沉淀生成,与(NH4)2CO3反应即生成沉淀又有气体,现象不同,可以区别,故D正确;
故选D.
点评:本题考查物质的区分和鉴别,学生熟悉物质之间的化学反应及反应的现象是解答的关键,题目难度不大.
本题难度:困难
5、选择题 水分子间可通过一种叫“氢键”的作用(介于化学键和范德瓦耳斯力大小之间),彼此结合而形成(H2O)n,在冰中的n值为5。即每个水分子都被其他4个水分子包围形成变形四面体,如图1-11所示为(H2O)5单元,由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体,即冰。下列有关叙述正确的是
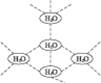
图1-11
A.1 mol冰中有4 mol氢键
B.1 mol冰中有4×5 mol氢键
C.平均每个水分子只有2个氢键
D.平均每个水分子只有5/4个氢键
参考答案:C
本题解析:在冰中每个水分子被4个水分子包围,即每2个水分子间存在一个氢键,每个氢键为2个水分子共用,在一个氢键中,每个水分子平均拥有1/2个氢键,而每个水分子可形成4个氢键,所以每个水分子平均含有氢键为:1/2×4=2个,也就是说1 mol冰中有2 mol“氢键”。
本题难度:简单