1、选择题 下列关于元素周期表的说法,错误的是
A.元素周期表是元素按原子序数大小排列而成的
B.元素原子的电子层数等于其所在周期的周期序数
C.元素原子的最外层电子数等于其所在族的族序数
D.元素周期表是元素周期律的具体表现形式
参考答案:C
本题解析:
本题难度:困难
2、选择题 下列离子组不能大量共存的是
A.K+、NO3-、CO32-、H+
B.Na+、K+、OH-、Cl-
C.Cu2+、H+、NO3-、SO42-
D.Ba2+、Na+、Cl-、SO42-
参考答案:AD
本题解析:分析:离子之间能结合生成水、气体、沉淀等,则离子不能共存,以此来解答.
解答:A.因CO32-、H+能结合生成水和气体,则不能共存,故A选;
B.因该组离子之间不反应,能共存,故B不选;
C.因该组离子之间不反应,能共存,故C不选;
D.因Ba2+、SO42-能结合生成沉淀,则不能共存,故D选;
故选AD.
点评:本题考查离子的共存,熟悉离子之间的反应即可解答,注意利用复分解反应发生的条件,题目难度不大.
本题难度:一般
3、选择题 官能团可以决定物质的性质,如同为一个碳原子的甲烷与甲醇,因为甲醇多了一个羟基,性质差别很大,但也有相似之处.下列属于甲烷与甲醇共同的性质的是
A.常温常压下是气态
B.都易溶于水
C.都能燃烧
D.都能与羧酸发生酯化反应
参考答案:C
本题解析:常温常压下,甲烷是气态,极难溶于水,可以燃烧发生氧化反应,也可以在光照下发生取代反应,但不可以发生酯化反应.常温常压下甲醇为液态,易溶于水,且能发生酯化反应.
本题难度:困难
4、选择题 已知硫酸溶液的密度随浓度增大而增大,若将质量分数分别为20%与50%的硫酸溶液等体积混和,则所得混合溶液的质量分数
A.35%
B.<35%
C.>35%
D.无法确定
参考答案:C
本题解析:分析:令质量分数分别为20%与50%的硫酸溶液的密度分别为xg/ml、yg/ml;硫酸溶液的密度随浓度增大而增大,所以x<y.假定体积为1ml,混合后溶质质量为混合前两溶液中溶质质量之和,混合后溶液质量为混合前溶液质量之和,根据质量分数定义用x、y表示出混合后的质量分数,结合密度关系判断.
解答:令质量分数分别为20%与50%的硫酸溶液的密度分别为xg/ml、yg/ml;硫酸溶液的密度随浓度增大而增大,所以x<y.
假定体积为1ml,则20%硫酸溶液的质量为1ml×xg/ml=xg,溶质硫酸的质量为xg×20%=20%xg.
50%的硫酸溶液的质量为1ml×yg/ml=yg,溶质硫酸的质量为yg×50%=50%yg.
所以混合后硫酸的质量分数为 =
=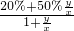 =
=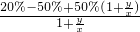 =50%-30
=50%-30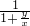 .
.
由于x<y,所以 >1,所以50%-30
>1,所以50%-30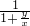 >35%.
>35%.
故选:C.
点评:本题考查溶液浓度的计算和大小比较,题目难度较大,注意硫酸的浓度越大密度越大.
本题难度:一般
5、选择题 NaCl在熔化状态下能导电,其本质原因是
A.电解质
B.存在能够自由移动的离子
C.存在电子
D.存在离子
参考答案:B
本题解析:导电原因,存在自由移动的离子
本题难度:困难