1、选择题 下列说法正确的是
A.含有金属元素的化合物一定是离子化合物
B.ⅠA族和ⅦA族元素原子化合时,一定形成离子键
C.由非金属元素形成的化合物一定是共价化合物
D.活泼金属与活泼非金属化合时,能形成离子键
参考答案:D
本题解析:试题分析:含有金属元素的化合物不一定是离子化合物,例如氯化铝是共价化合物,A不正确;B不正确,例如氯化氢是共价化合物;C不正确,例如氯化铵是离子化合物,因此正确的答案选D。
考点:考查化学键、化合物的有关判断
点评:该题是高考中的常见题型, 属于中等难度的试题。试题基础性强,侧重对学生能力的培养和解题方法的指导和训练。该题的关键是学会通过举例排除逐一筛选得出正确结论的解题方法,有利于培养学生的应试能力。
本题难度:困难
2、选择题 含有非极性键的化合物是
A.H2O2
B.HCl
C.Cl2
D.NaOH
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列说法正确的是
A.HF、HCl、HBr、HI的熔点沸点依次升高。
B.H2O的熔点、沸点大于H2S的是由于H2O分子之间存在氢键。
C.乙醇分子与水分子之间只存在范德华力。
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
参考答案:B
本题解析:HF中含有氢键,所以熔沸点最高,A不正确。在乙醇分子间也存在氢键,C不正确。D是错误的,高氯酸的酸性最强,酸性由弱到强排列为HClO<HClO2<HClO3<HClO4。所以正确的答案是B。
本题难度:一般
4、选择题 下面的排序不正确的是
A.晶体熔点由低到高:CF4< CCl4< CBr4< Cl4
B.硬度由大到小:金刚石 > 碳化硅 > 晶体硅
C.熔点由高到低:Na > Mg > Al
D.晶体的熔点高低规律一般有:原子晶体 > 离子晶体 > 分子晶体
参考答案:C
本题解析:A中都是分子晶体,熔点和分子间作用力有关系,相对分子质量越大,分子间作用力越强,A正确;B中都是原子晶体,硬度与共价键强弱有关系,形成共价键的原子半径越小,键越强,所以B正确;C中都是金属晶体,熔点和金属键强弱有关系,形成金属键的金属阳离子半径越小,电荷数越多,金属键越强,熔点越高,所以C不正确,应该是Na < Mg <Al;D正确,所以答案选C。
本题难度:简单
5、选择题 下图所示为某晶体的一个晶胞,该晶体由A、B、C三种基本粒子组成。试根据晶胞判断,该晶体的化学式为
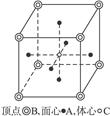
A.A6B8C
B.A2B4C
C.A3BC
D.A3B4C
参考答案:C
本题解析:观察题中该晶胞的结构,可知处于立方体顶点上的每个B粒子为8个相邻的立方体所共有,因此属于一个晶胞的B粒子共有:8× =1个。排在面心上的6个A粒子,每个为相邻的2个立方体所共有,因此属于一个晶胞的A为:6×
=1个。排在面心上的6个A粒子,每个为相邻的2个立方体所共有,因此属于一个晶胞的A为:6× =3个。位于立方体体心的C粒子,为单个晶胞所拥有。故每个立方体拥有3个A粒子、1个B粒子、1个C粒子,即该晶体的化学式为A3BC。
=3个。位于立方体体心的C粒子,为单个晶胞所拥有。故每个立方体拥有3个A粒子、1个B粒子、1个C粒子,即该晶体的化学式为A3BC。
本题难度:困难