1、选择题 属于定量仪器的是
A.试管
B.烧杯
C.量筒
D.锥形瓶
参考答案:C
本题解析:图中试管和烧杯、锥形瓶可做反应容器,量筒是量度液体药品体积的,所以涉及定量的问题的仪器的是量筒.故C选项正确。
本题难度:简单
2、实验题 (16分)实验是进行化学研究的重要手段之一。请回答下列问题:
(1)下列实验操作,错误的是____________________(填写序号)。
a. 用纸槽往试管里装粉末状药品时,试管应先横放再直立
b. 称取氢氧化钠固体时,应将氢氧化钠固体直接放在左边托盘内,右边托盘放砝码
c. 试管、烧杯、量筒、集气瓶都不能用酒精灯直接加热
d.用试纸检验气体性质时,手拿着试纸经水润洗后靠近气体观察试纸颜色的变化
e.闻气体气味时,应取一瓶盛满气体的集气瓶,稍打开玻璃片,用手轻轻扇地在瓶口扇动,使极少量的气体飘进鼻孔,闻气味
(2)实验室需要450mL 0.1mol·L-1NaOH溶液和500mL 0.5 mol·L-1硫酸溶液。请回答下
列问题:
①在右图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有?。
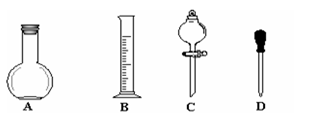
②在容量瓶的使用方法中,下列操作正确的是____________(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流注入容量瓶中,然后加蒸馏水。
d.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
③配制450 mL 0.1 mol·L-1 NaOH溶液的实验步骤如下:
a.计算应称取氢氧化钠固体的质量为________g。
b.称量氢氧化钠固体。
c.将烧杯中的溶液注入容量瓶,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也注入容
量瓶。
d.用适量的蒸馏水溶解称量好的氢氧化钠固体,冷却。
e.盖好瓶塞,反复上下颠倒,摇匀。
f.继续向容量瓶中加蒸馏水至刻度线下1~2cm时,改用胶头滴管滴加蒸馏水至凹液面与
刻度线相切。
上述步骤的正确操作顺序为_______________________(用序号表示)。
④根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为?mL,如果实验室有15mL、20mL、50mL量筒,应选用?mL量筒最好。
参考答案:(16分)(1) bcd(2分)
(2)① A C(2分)?烧杯、玻璃棒、500mL容量瓶(2分,每少一种扣1分)
② ?ad(2分)?③2.0(2分) ?abdcfe(2分)
④13.6(2分)?15(2分)
本题解析:考查实验基本操作及溶液的配制
(1)a:正确;
b:由于NaOH有强腐蚀性及吸水性,一般用小烧杯盛放后置于天平左盘
c:试管可以直接加热
d:手不能直接接触试纸,以防污染
e:正确
(2)①配制或稀释溶液的过程中不需要平底烧瓶、分液漏斗;所需要的仪器还有烧杯、玻璃棒、500mL容量瓶
②a:正确
b:容量瓶只需要用水洗涤干净即可,不能用待配制溶液润洗
c:不管是溶解固体还是稀释浓溶液,都应该用烧杯进行,容量瓶只能用来配制溶液
d:正确
③所需氢氧化钠固体的质量:0.5×0.1×40=2.0g
正确的配制溶液的步骤为:计算、称量、溶解、洗涤、定容、摇匀
④浓硫酸的体积为:V×1.84×98%/98=0.5×0.5,得V=13.6ml
应选用容积略大于13.6ml的量筒即:15ml
本题难度:一般
3、选择题 对下列装置,不添加其他仪器无法检查气密性的是( )
A.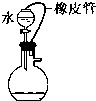
B.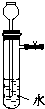
C.
D.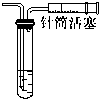
参考答案:A.图中的装置分液漏斗液面上的气体与烧瓶内气体相通,分液漏斗中的液体上下压强相等,所以无论该装置气密性是否良好,液体都会顺利滴下,所以不能检查出装置是否漏气,故A正确;
B.用弹簧夹夹住右边导管,向长颈漏斗中倒水,若液面高度不变,说明装置气密性良好,所以能检查出装置是否漏气,故B错误;
C.对于该装置的气密性检查,主要是通过气体受热后体积膨胀、压强增大来进行检验.即用手握住试管外壁,如果装置漏气,压强不变化,就无现象;如果装置不漏气,温度升高,压强就变大就会在导管口产生气泡,所以能检查出装置是否漏气,故C错误;
D.图中的装置向外拉活塞,若气密性良好,则导管口会有气泡产生,若气密性不好则不会有气泡产生,所以能检查出装置是否漏气,故D错误;
故选A.
本题解析:
本题难度:一般
4、实验题

试回答下列问题:
(1)实验Ⅰ中D 的成分是___________称量后_________(填“能”或“不能”)通过计算得到A中各组分的质量比.
(2)实验II 填写的内容中明显错误的是________,其原因________________________
(3)对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内,最终能得出A中各组分的质量比为:(用含字母的表达式表示)____________________________
参考答案:⑴BaCl2、NaCl?不能⑵D? D中不仅含有NaCl,还有Na2CO3?加入的Na2CO3是过量的⑶过量NaOH溶液(等合理答案)? Mg(OH)2?Na2SO4和 NaOH?A 、C?(A-(120C/58)):(120C/58)
本题解析:本题以化学实验基础知识为载体来测定混合物的组成,充分考查考生的实验能力。实验Ⅰ中通入CO2并未反应,所以D中成分还是BaCl2与NaCl;实验II中Na2CO3是过量的,滤液中还有Na2CO3;实验Ⅲ中可将Mg2+沉淀下来,然后通过称量质量求质量比。
本题难度:一般
5、选择题 时钟反应或振荡反应提供了迷人课堂演示实验,也是一个活跃的研究领域。测定含有I—浓度很小的碘化物溶液时,利用振荡反应进行化学放大,以求出原溶液中碘离子的浓度。主要步骤如是:
①在中性溶液中,用溴将试样中I-氧化成IO3-,将过量的溴除去。
②再加入过量的KI,在酸性条件下,使IO3-完全转化成I2。
③将②中生成的碘完全萃取后,用肼将其还原成I-,方程式为:N2H4+2I2=4I-+N2+4H+
④将生成的I-萃取到水层后用①法处理。
⑤将④得到的溶液加入适量的KI溶液,并用硫酸酸化。
⑥将⑤反应后的溶液以淀粉作指示剂,用Na2S2O3标准溶液滴定,方程式为:
2Na2S2O3+I2 Na2S4O6+2NaI经过上述放大后,溶液中I-浓度放大为原溶液中I-浓度的(设前后溶液体积相等)
Na2S4O6+2NaI经过上述放大后,溶液中I-浓度放大为原溶液中I-浓度的(设前后溶液体积相等)
A.2倍
B.4倍
C.36倍
D.6倍
参考答案:C
本题解析:①第一步:I-+3Br2+3H2O=6Br-+IO3-+6H+;I-浓度不变;
②第二步:IO3-+5I-+6H+=3I2+3H2O;1个IO3-生成3个I2,从第三步反应看出,I-浓度放大了6倍;
③第三步:N2H4+2I2=4I-+N2↑+4H+;1个I2生成2个I-;
④第四步:I-+3Br2+3H2O=6Br-+IO3-+6H+;I-浓度不变;
⑤第五步:IO3-+5I-+6H+=3I2+3H2O;1个IO3-生成3个I2,从第三步反应看出,I-浓度放大了6倍;
⑥第六步:2Na2S2O3+I2=Na2S4O6+2NaI,离子方程式为:2S2O32-+I2=S4O62-+2I-;1个I2生成2个I-;
因此从以上方程式和分析可得关系式:I~IO3-~3I2~6I-~6IO3-~18I2~36S2SO32-~36I-,
1? 3? 6? 6? 18? 36
总计放大倍数为:6×6=36倍.
故选C.
本题难度:一般