| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《有关氧化还原反应的计算》高频试题巩固(2017年最新版)(一)
2、选择题 下列有关化学用语或名称 3、选择题 下列各项中表达正确的是(?) 4、选择题 溴化碘(IBr)的化学性质跟卤素单质相似,它跟水反应的化学方程式为: IBr + H2O =" HBr" + HIO,下列有关的叙述中,不正确的是(?) 5、简答题 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算: [-page-来源:91考试网 91EXAm.org] 1、选择题 水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2 +xOH-=Fe(FeO2)2+S4O62-+2H2O |
参考答案:C
本题解析:A、由反应方程式知,每生成1mol Fe(FeO2)2时1molO2参加反应,转移的电子为4mol,正确;B、该反应中铁元素的化合价由+2价升高到+3价,硫元素的化合价由+2价升高到+2.5价,该反应中Fe2+和S2O32-都是还原剂,正确;C、由反应方程式知,3molFe2+参加反应时只有2mol被氧化,此时该反应中1molO2被还原,错误;D、根据电荷守恒可知, x=4,正确。
考点:考查氧化还原反应和离子反应方程式。
本题难度:一般
2、选择题 下列有关化学用语或名称 ,表达错误的是
,表达错误的是
A.葡萄糖的分子式:C6H12O6
B.苯分子的比例模型:
C.乙炔的电子式: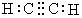

D. 的名称:硝基苯
的名称:硝基苯
参考答案:D
本题解析:略
本题难度:一般
3、选择题 下列各项中表达正确的是(?)
A.CO2的分子模型:
B.F—结构示意图: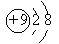
C.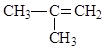 2-甲基-2-丙烯
2-甲基-2-丙烯
D.HCl的电子式为: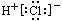
参考答案:B
本题解析:A:CO2为直线型分子,不正确
B:正确
C:应从碳碳双键近的一端编号,不正确
D:HCl为共价化合物,不正确
本题难度:一般
4、选择题 溴化碘(IBr)的化学性质跟卤素单质相似,它跟水反应的化学方程式为: IBr + H2O =" HBr" + HIO,下列有关的叙述中,不正确的是(?)
A.IBr是双原子分子? B.在很多反应中,IBr是氧化剂
参考答案:C.和NaOH溶液反应生成NaBr? D. 和H2O反应时,IBr既是氧化剂又是还原剂18.南方都市报06D
本题解析:略
本题难度:一般
5、简答题 1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O.现将23.2g含MnO2的质量分数为75%的软锰矿石与足量10mol/L浓盐酸完全反应(杂质不参加反应).把反应后所得溶液稀释成200ml.计算:
(1)生成的Cl2的体积(标准状况).
(2)参加反应的浓盐酸的体积.
(3)稀释后溶液中MnCl2的物质的量浓度.
参考答案:(1)23.2g含MnO2的质量分数为75%的软锰矿石中MnO2的物质的量为:23.2g×75%87g/mol=0.2mol,则:
MnO2+4HCl(浓)?△?.?MnCl2+Cl2↑+2H2O
1? 1
0.2mol? n(Cl2)
所以n(Cl2)=0.2mol,故V(n(Cl2)=0.2mol×22.4L/mol=4.48L,
答:标准状况下生成的Cl2的体积为4.48L;
(2)由方程式可知,参加反应的HCl的物质的量为0.2mol×4=0.8mol,故参加反应的浓盐酸的体积为0.8mol10mol/L=0.08L,
答:参加反应的浓盐酸的体积是0.08L;
(3)消耗前后氯化锰的物质的量不变,由方程式可知n(MnCl2)=n(MnO2)=0.2mol,将反应后所得溶液稀释成200mL,稀释后液中MnCl2的物质的量浓度为0.2mol0.2L=1mol/L,
答:稀释后液中MnCl2的物质的量浓度为1mol/L.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《绿色化学》.. | |