1、选择题 20g由两种金属粉末组成的混合物,与足量的盐酸反应后得倒11.2L氢气(标准状况下),这种金属混合物的组成可能是
[? ]
A、Mg和Al
B、Al和Fe
C、Fe和Zn
D、Zn和Cu
参考答案:B
本题解析:
本题难度:一般
2、计算题 某同学取一定量的Al和Fe固体混合物,与2.0?L极稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4?mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。
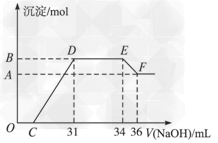
试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为__________。 在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为___________;上述现象说明溶液中______________结合OH-的能力比___________强(填写离子符号)。
(2)B与A的差值为______________mol。
(3)B点对应的沉淀的物质的量为____________mol,C点对应的氢氧化钠溶液的体积为______________mL。
(4)求原硝酸溶液的物质的量浓度??
参考答案:(1)H+?+?OH- →?H2O?;NH4+?+?OH-?→?NH3·H2O?;Al3+、Fe3+?;?NH4+?
(2)0.008?
(3)0.032?;7?
(4)0.074
本题解析:
本题难度:一般
3、计算题 把SO2通入NaOH溶液中,当完全反应时,其质量比为 6:5,求:
(1)反应物有无剩余?
(2)结晶后固体由何种物质组成?
参考答案:(1)二氧化硫有剩余;
(2)NaHSO3。
本题解析:
本题难度:一般
4、填空题 Na、Mg、Al分别与盐酸反应:
(1)若盐酸足量,等物质的量的Na、Mg、Al产生H2的质量之比为___________。
(2)若盐酸足量,等质量的Na、Mg、Al产生H2的质量之比为__________,反应后溶液增重的质量之比为________________。
参考答案:(1)1:2:3
(2)1/23 :1/12 :1/9;22/23 :11/12 :8/9
本题解析:
本题难度:一般
5、选择题 一定质量的铁和铜的混合物,与一定浓度的硝酸反应后容器中没有固体剩余,生成标准状况下2.24LNO和4.48LNO2(不考虑N2O4的存在)的混合气体,则参加反应的HNO3的物质的量是
[? ]
A.0.5 mol
B.0.8 mol
C.1.0 mol
D.1.6 mol
参考答案:B
本题解析:
本题难度:一般