1、选择题 下列元素属于卤族元素的是
A.F
B.P
C.He
D.Li
参考答案:A
本题解析:卤族元素的最外层电子数都是7个,P的最外层电子数是5,He是2,Li是1,F是7,即选项A正确。答案选A。
本题难度:简单
2、选择题 1.56 g某碱金属与足量盐酸反应,得到标准状况下的氢气448 mL,该金属的相对原子质量为
A.85
B.24
C.39
D.7
参考答案:C
本题解析:根据2R+2HCl====2RCl+H2↑,可得碱金属的物质的量为0.04 mol,所以该碱金属的摩尔质量为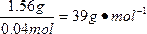 。
。
本题难度:一般
3、选择题 将0.1mol无水硫酸铜固体于强热下完全分解,得到Cu2O与SO3、SO2、O2的混合气体,该混合气体的平均式量可能为
A.32
B.48
C.64
D.72
参考答案:C
本题解析:分析:CuSO4分解得到Cu2O、SO3、SO2、O2,根据质量守恒定律可知,混合气体的总质量一定,利用硫原子守恒可知,硫的氧化物的物质的量之和为0.1mol,故混合气体的平均式量取决于氧气的物质的量,反应中铜元素的化合价降低,一定会有元素化合价升高,一定有氧气生成,利用极限法分析,根据电子转移守恒可知,当产生的气体为SO3和O2时,O2的物质的量最小,混合气体的物质的量最小,平均式量最大;产生的气体为O2和SO2时,O2的物质的量最大,混合气体的物质的量最大,平均式量最小;
根据铜原子守恒计算Cu2O的物质的量,再根据m=nM计算Cu2O的质量,进而计算混合气体的物质的量,根据极限法,利用电子转移守恒计算氧气的物质的量,进而计算平均式量的极值,据此判断.
解答:CuSO4分解得到Cu2O、SO3、SO2、O2,根据质量守恒定律可知,混合气体的总质量一定,利用硫原子守恒可知,硫的氧化物的物质的量之和为0.1mol,故混合气体的平均式量取决于氧气的物质的量;
根据铜原子守恒可知,n(Cu2O)=0.05mol,故m(Cu2O)=0.05mol×144g/mol=7.2g,
故 混合气体的质量为:0.1mol×160g/mol-7.2g=8.8g,
反应中铜元素的化合价降低,一定会有元素化合价升高,一定有氧气生成,根据电子转移守恒可知:
①当产生的气体为SO3和O2时,O2的物质的量最小,混合气体的物质的量最小,平均式量最大,由电子转移守恒可知,此时O2的物质的量为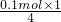 =0.025mol,由硫原子守恒可知n(SO3)=0.1mol,故混合气体的平均式量最大值为
=0.025mol,由硫原子守恒可知n(SO3)=0.1mol,故混合气体的平均式量最大值为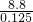 =70.4;
=70.4;
②当产生的气体为O2和SO2时,O2的物质的量最大,混合气体的物质的量最大,平均式量最小,由硫原子守恒可知n(SO2)=0.1mol,由电子转移守恒可知,此时O2的物质的量为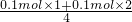 =0.075mol,故混合气体的平均式量最小值为
=0.075mol,故混合气体的平均式量最小值为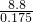 =50.3;
=50.3;
由于实际混合气体是SO3、SO2、O2三种气体的混合气体,故其平均式量应该在50.3~70.4之间,
故选C.
点评:本题考查混合物的有关计算,难度中等,注意利用极限法确定极值进行解答,关键是确定混合气体物质的量的极值.
本题难度:一般
4、选择题 在25℃,101KPa下由HCHO(g)、H2和CO组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与2.24L氧气(标准状况)充分反应后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为
A.等于6.72g
B.小于6.72g
C.大于6.72g
D.无法计算
参考答案:B
本题解析:分析:H2和CO与氧气反应生成二氧化碳和水,二氧化碳和水与过氧化钠反应,都使Na2O2粉末增重,根据方程式可知,二氧化碳与过氧化钠反应增重为开始CO的质量,水与过氧化钠反应增重为开始H2的质量,HCHO(g)与氧气反应生成二氧化碳和水,
HCHO相当于H2和CO按1:1混合,其燃烧生成二氧化碳和水,所以使Na2O2粉末增重为HCHO的质量.
根据相对氢气的密度为14,计算混合气体平均摩尔质量,计算出混合气体的物质的量,根据方程式判断混合物是否完全燃烧,若HCHO(g)、H2和CO组成的混合气体完全燃烧,则Na2O2粉末增重为混合气体的质量.若不能完全燃烧则Na2O2粉末增重小于混合气体的质量.
解答:混合气体相对氢气的密度为14,所以混合气体平均摩尔质量为2g/mol×14=28g/mol.
6.72g混合气体的物质的量为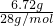 =0.24mol.
=0.24mol.
氧气的物质的量为 =0.1mol.
=0.1mol.
根据方程式
2CO+O2=2CO2;
2H2+O2=2H2O;
HCHO+O2=CO2+H2O;
可知混合物完全燃烧需氧气的物质的量大于0.24mol× =0.12mol>0.1mol,所以混合物不能完全燃烧,Na2O2粉末增重小于混合气体的质量,即小于6.72g.
=0.12mol>0.1mol,所以混合物不能完全燃烧,Na2O2粉末增重小于混合气体的质量,即小于6.72g.
故选:B.
点评:解题关键清楚:1、若HCHO(g)、H2和CO组成的混合气体完全燃烧,则Na2O2粉末增重为混合气体的质量.若不能完全燃烧则Na2O2粉末增重小于混合气体的质量.2、根据方程式判断混合物完全燃烧需氧气量.
本题难度:简单
5、选择题 金属钠着火时,可以灭火的物质是
A.水
B.砂子
C.煤油
D.二氧化碳
参考答案:B
本题解析:答案B。
金属钠着火时,可以B.砂子灭火。A中水与Na反应;C.煤油易燃;?D.二氧化碳能支持钠燃烧。
本题难度:一般