1、选择题 下面叙述正确的是(?)
A.同族非金属元素,自上而下所形成的酸,其酸性渐弱,因为成酸元素的非金属性渐弱
B.同族非金属的最低价阴离子,由上而下其还原性渐强,而氧化性渐弱
C.同主族元素的单质,金属则越向下熔点基本上越低,非金属则越高
D.元素周期表中Ⅲ B族的元素种类最多
参考答案:D
本题解析:
【错解分析】误区主要是审题不够引起的。
【正解】同族非金属越向下非金属性越弱,表现在一般是其最高价态时形成的含氧酸的酸性越强,而不是泛指所有酸,因为无氧酸的酸性却有渐强趋势,如H2S比H2O的酸性强,PH3比NH3的碱性弱,HF,HCl,HBr,HI则酸性增强。A不正确。
非金属最低价的阴离子,只能失电子而不能再得电子,所以同族非金属最低价阴离子越向下,还原性越强是正确的。“氧化性越弱”则不正确。
从周期表中的各主族单质熔点看,则金属在同族中大致的熔点情况是越向下越低,仅个别有例外,如Ga比In熔点低、Sn比Pb熔点低等。非金属单质则越向下基本上熔点越高。但C比Si的熔点高。所以C不正确。
本题难度:简单
2、选择题 .已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.第一电离能:Y可能大于或小于X
B.气态氢化物的稳定性:HmY强于HnX
C.最高价含氧酸的酸性X强于Y
D.X和Y形成化合物时,X显负价Y显正价
参考答案:B
本题解析:略
本题难度:一般
3、选择题 X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素。其中Z是金属,W的单质是淡黄色固体,X、Y、W在周期表中的相对位置关系如下图所示,下列说法一定正确的是

A.最高价氧化物对应水化物的酸性最强的是W
B.Y与Z只能形成一种化合物
C.简单阴离子还原性:Y>W
D.Z与Q形成的化合物水溶液可能显酸性
参考答案:D
本题解析:短周期元素W的单质为淡黄色固体,则W是S元素,Y是O元素,X是C元素,因为X、Y、Z、W、Q是原子序数依次增大的五种短周期主族元素,则Q是Cl元素,其中Z的原子序数大于8又小于16的金属元素 ,可能是Na、Mg、Al中的一种。A. 在这五种元素中非金属性最强的是Cl,所以最高价氧化物对应水化物的酸性最强的是HClO4。错误。B.若Z是Na元素,则可以形成Na2O、Na2O2两种氧化物。若Z是Mg、Al,则只能形成一种氧化物MgO或Al2O3.错误。C.O、S是同主族的元素。从上到下,元素的非金属性逐渐减弱,则其简单阴离子还原性逐渐增强。元素的非金属性O>S,所以还原性S2->O2-。错误。D. 若Z为Mg或Al,则MgCl2、AlCl3都是强酸弱碱盐,金属阳离子发生水解反应消耗水电离产生的OH-而使溶液中的H+浓度增大,溶液显酸性。正确。
本题难度:一般
4、选择题 下列电子式不正确的是
A.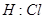
B.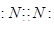
C.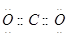
D.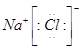
参考答案:A
本题解析:氯化氢中氯原子还存在不参与成键的电子,正确的电子式为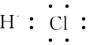 ,其余都是正确的,答案选A。
,其余都是正确的,答案选A。
本题难度:简单
5、选择题 下列化学式既能表示物质的组成,又能表示物质的分子式的是
[? ]
A.NH4NO3
B.SiO2
C.C6H5NO2
D.Cu
参考答案:C
本题解析:
本题难度:简单