1、选择题 在1 LK2SO4和CuSO4的混合溶液中,c(SO42-)=2.0 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4 L(标况)气体,则原溶液中K+的物质的量浓度为?(?)
A.2.0 mol·L-1
B.1.5 mol·L-1
C.1.0mol·L-1
D.0.5 mol·L-1
参考答案:A
本题解析:略
本题难度:一般
2、实验题 (16分)由于Fe(OH)2极易被氧化;所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀。若用图所示实验装置则可制得纯净的Fe(OH)2沉淀。两极材料分别为石墨和铁。
(1)a电极材料为________,其电极反应式为_______________.
(2)电解液d可以是________,则白色沉淀在电极上生成;也可以是________,则白色沉淀在两极之间的溶液中生成。(填字母代号)
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是: ;在加入苯之前,对d溶液进行加热煮沸处理的目的是: .
(4)为了在短时间内看到白色沉淀,可以采取的措施是 。
A.改用稀硫酸做电解液
B.适当增大电源电压
C.适当缩小两电极间距离
D.适当降低电解液温度
(5)若d改为Na2SO4溶液,当电解一段时间,看到白色沉淀后,再反接电源,继续电解,除了电极上看到气泡外,另一明显现象为: .
写出反接后两极的电极反应式:
阳极:
阴极:
参考答案:(1)Fe Fe—2e—=Fe2+(2)C B ;(3)隔绝空气防止Fe(OH)2被空气氧化;排尽溶液中的氧气,防止生成Fe(OH)2在溶液中氧化;(4)B C ;(5)白色沉淀迅速变化成灰绿色,最后变成红褐色;2H2O-4e-==O2↑+4H+; 2H2O+2e-==H2↑+2OH-
本题解析:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,b与电源正极相连,则b为阳极,发生的电极反应为Fe-2e-=Fe2+,故答案为:Fe;Fe-2e-=Fe2+;(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2,则电解液b可选择BC,故答案为:BC;(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热煮沸的目的是排出溶液中的氧气,故答案为:隔绝空气防止氢氧化亚铁被氧化;加热煮沸;(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC.(5)反接电源时,电解方程式是2H2O=2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色.答案为白色沉淀迅速变化成灰绿色,最后变成红褐色;2H2O-4e-==O2↑+4H+; 2H2O+2e-==H2↑+2OH-
考点:电极反应式的书写
本题难度:困难
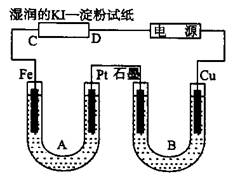
3、填空题 如图所示,装置B部分盛有1 L?2 mol/L Na2SO4溶液,装置A部分盛有1 L?2 mol/L?AgNO3溶液。通电后,湿润的KI淀粉试纸的C端变蓝色,试回答下列问题:
 ?
?
⑴A中发生反应的化学方程式为?。
⑵在B中观察到的现象是?。
⑶室温下,若从电解开始到时间为T时,A、B装置中共收集到气体0.168L(标准状况),若电解过程中无其它副反应发生,且溶液体积变化忽略不计,则在时间T时,A溶液的c(H+)为?。
参考答案:⑴4AgNO3?+? 2H2O?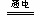 ?4Ag?+? O2↑+? 4HNO3;⑵石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生;⑶0.0100mol·
?4Ag?+? O2↑+? 4HNO3;⑵石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生;⑶0.0100mol· 。
。
本题解析:由湿润的KI淀粉试纸的C端变蓝色,可知在C端I-被氧化成I2,即C端为阳极,进而得到电源的右端为正极,左端为负极,由此得A装置中Fe棒为阴极,Pt为阳极,则A中电解的总反应式为:4AgNO3?+? 2H2O?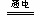 ?4Ag?+? O2↑+? 4HNO3。B装置中Cu棒为阳极,由此得到B中的现象为石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生,A、B装置收集的气体分别是O2和H2,有电子守恒得,n(O2)=
?4Ag?+? O2↑+? 4HNO3。B装置中Cu棒为阳极,由此得到B中的现象为石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生,A、B装置收集的气体分别是O2和H2,有电子守恒得,n(O2)=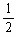 n(H2),所以,n(O2)=
n(H2),所以,n(O2)= ×
×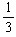 =0.0025mol,由A总反应得n(HNO3)= 4n(O2)=0.0100mol,故c(H+)=
=0.0025mol,由A总反应得n(HNO3)= 4n(O2)=0.0100mol,故c(H+)= 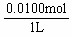 =0.0100mol·
=0.0100mol· 。
。
本题难度:一般
4、选择题 下列有关原电池和电解池的叙述中正确的是( )
A.钢管大部分浸在淡水中,主要发生析氢腐蚀
B.钢管若采用外加电流的阴极保护措施,应当与电源的正极相连
C.钢管若需保护,可采用牺牲阳极的阴极保护法
D.电解氯化钠溶液时电子从负极经过溶液流向正极
参考答案:A、中性溶液中金属的腐蚀以吸氧腐蚀为主,强酸性环境中,金属主要发生析氢腐蚀,故A错误;
B、活泼金属作阳极,则在阳极上放电的是金属,会加快金属的腐蚀,故B错误;
C、金属做原电池的正极(即发生还原反应的阴极)可以被保护,故C正确;
D、电解池中,阳极为失去电子的极,电子从阳极经外电路流向阴极,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 用惰性电极电解CuCl2和CuSO4混合溶液(浓度均为0.01摩/升)500毫升,当阴极析出0.48克Cu时,在标准状况下,阳极可得到的气体约为?
A.0.168升
B.0.14升
C.0.336升
D.0.24升
参考答案:B
本题解析:惰性电极电解CuCl2与CuSO4的混合溶液,阴极析出Cu,阳极先是2Cl--2e=Cl2,然后若还有电子转移,应为4OH--4e=2H2O+O2
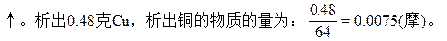
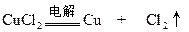
0.01×0.5? 0.005? 0.005
=0.005
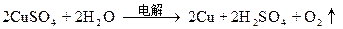
0.0075-0.005? 0.00125
=0.0025
∴阳极的气体V=(0.005+0.00125)×22.4=0.14(升)
本题难度:一般