1、选择题 Li- Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++ FeS +2e-=Li2S+Fe 有关该电池的下列说法中,正确的是
[? ]
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为:Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+ Fe-2e-=2Li++FeS
参考答案:B
本题解析:
本题难度:一般
2、选择题 如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是(? )
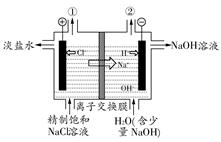
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为:2Cl-+2H+ Cl2↑+H2↑
Cl2↑+H2↑
D.该装置是将电能转化为化学能
参考答案:C
本题解析:出口①处的电极与电源正极相连,作阳极,电极反应为2Cl--2e-=Cl2↑,出口②处的电极与电源负极相连,作阴极,电极反应为2H++2e-=H2↑,其中H+来自水电离,H+不断放电,水电离向正方向移动,产生OH-,故总反应为2Cl-+2H2O 2OH-+Cl2↑+H2↑。电解过程是将电能转化为化学能。该离子交换膜是阳离子交换膜,只允许阳离子通过,而不允许阴离子通过。
2OH-+Cl2↑+H2↑。电解过程是将电能转化为化学能。该离子交换膜是阳离子交换膜,只允许阳离子通过,而不允许阴离子通过。
本题难度:简单
3、选择题 用石墨作电极电解CuCl2溶液,当通电一段时间后,收集到2.24 L气体(标准状况)。下列有关说法正确的是?(?)
A 阳极生成的铜?
B 上述电解过程中共转移0.2 mol电子
C 电解得到的Cu的物质的量为0.5 mol?
D 电解后溶液呈碱性
参考答案:B
本题解析:
正确答案:B
A、不正确,阳极生成Cl2; B 正确,生成0.1molCl2,过程中共转移0.2 mol电子(注本题不严谨,应交待CuCl2足量,否则可能电解水)C 不正确,电解得到的Cu的物质的量为0.1mol?
D、不正确,电解后溶液呈弱酸性或中性,CuCl2过量,水解呈酸性,或生成的Cl2溶于水也呈酸性,如只剩下水,呈中性。
本题难度:简单
4、选择题 石墨作电极电解下列溶液,阴阳两极产生的气体体积比为2:1,且电解液pH增大的是
[? ]
A.KCl
B.NaOH
C.Na2SO4
D.H2SO4
参考答案:B
本题解析:
本题难度:一般
5、选择题 铝阳极氧化处理后形成的氧化膜比铝的天然氧化膜耐磨性、耐腐蚀性及装饰性有明显的提高,工业中以铝为阳极,置于硫酸溶液中电解,装置如图所示,下列说法正确的是
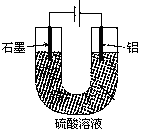
A.阳极电极方程式为: Al—3e—+6OH—=Al2O3+H2O
B.随着电解的进行,溶液的pH逐渐增大
C.当阴极生成气体3.36L(标况)时,阳极增重2.4g
D.电解过程中H+移向Al电极
参考答案:C
本题解析:A、电解质为硫酸溶液,OH?不可能参加反应,错误;B、根据原电池装置和题目信息可知电解总反应为:2Al+3H2O  Al2O3+3H2↑,H2O减少,溶液的pH逐渐减小,错误;C、阴极反应为:2H++2e?=H2↑,H2的物质的量为3.36L÷22.4L/mol=0.15mol,则转移电子为:2×0.15mol=0.3mol,阳极反应为:根据差量法进行计算:设阳极增重的质量为x,
Al2O3+3H2↑,H2O减少,溶液的pH逐渐减小,错误;C、阴极反应为:2H++2e?=H2↑,H2的物质的量为3.36L÷22.4L/mol=0.15mol,则转移电子为:2×0.15mol=0.3mol,阳极反应为:根据差量法进行计算:设阳极增重的质量为x,
2Al+3H2O-6e?=Al2O3+6H+?m
6mol? 48g
0.3mol? x
6mol:0.3mol=48g:x,解得x=2.4g,即阳极增重2.4g,正确;D、根据电流的方向可知,阳离子移向阴极,所以H+移向石墨电极,错误。
本题难度:一般