1、选择题 有甲、乙两个相同的恒容密闭容器,体积均为0.25 L,在相同温度下均发生可逆反应:X2(g)+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1。实验测得起始、平衡时的有关数据如表所示:
容器编号
| 起始时各物质的物质的量/mol
| 平衡时体系
能量的变化
|
X2
| Y2
| XY3
|
甲
| 1
| 3
| 0
| 放出热量:23.15 kJ
|
乙
| 0.9
| 2.7
| 0.2
| 放出热量:Q
|
?
下列叙述错误的是( )
A.若容器甲体积为0.5 L,则平衡时放出的热量小于23.15 kJ
B.容器乙中达平衡时放出的热量Q=23.15 kJ
C.容器甲、乙中反应的平衡常数相等
D.平衡时,两个容器中XY3的体积分数均为1/7
参考答案:B
本题解析:平衡常数属于温度的函数,相同温度下两容器中反应的平衡常数相同。若容器甲的体积增大一倍,平衡逆向移动,故放出的热量小于23.15 kJ。根据热量的变化可计算出XY3的生成量。
本题难度:一般
2、选择题 用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加快的是
[? ]
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量的Cu(NO3)2溶液
D.不用铁片改成铁粉
参考答案:B
本题解析:
本题难度:一般
3、选择题 一定量的Zn与足量的稀盐酸反应制氢气,为了加快制取氢气的速率且不影响制得氢气的量,向稀盐酸中加入下列物质:①石墨粉②CuO ③Pt粉④Cu粉⑤Fe粉,
其中可行的是
A.①②③④⑤
B.①③⑤
C.①③④⑤
D.①③④
参考答案:D
本题解析:考查外界条件对反应速率的影响。在其它条件不变的情况下,增大反应物浓度或升高温度或使用催化剂或增大反应物的接触面积或通过原电池反应等均可以加快反应速率。①③④均是构成原电池。氧化铜可以和盐酸反应生成氯化铜,然后锌置换出铜,构成原电池加快反应速率,但由于消耗了锌,使用生成的氢气减少。铁是活泼的金属和盐酸反应生成氢气,增大氢气的体积,使用答案只能是D。
本题难度:一般
4、选择题 设C+CO2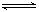 2CO-Q1,反应速率V1;N2+ 3 H2
2CO-Q1,反应速率V1;N2+ 3 H2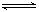 2NH3+Q2反应速率V2 。对于上述反应,当温度升高时,V1和V2的变化情况为(?)
2NH3+Q2反应速率V2 。对于上述反应,当温度升高时,V1和V2的变化情况为(?)
A.同时增大
B.同时减小
C.V1增大,V2减小
D.V1减小,V2增大
参考答案:A
本题解析:考查外界条件对反应速率的影响。只要升高温度,反应速率就一定加快,所以答案选A。
本题难度:一般
5、选择题 2SO2+O2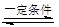 2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是(? )
2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是(? )
A.减少O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂不影响反应速率
D.一定条件下达到反应限度时SO2部分转化为SO3
参考答案:D
本题解析:A、减少O2的浓度能减慢反应速率,错误;B、温度降低,反应速率减慢,错误;C、一般使用催化剂可以加快反应速率,错误;D、可逆反应的特点是反应物不能全部转化为生成物,所以一定条件下达到反应限度时SO2部分转化为SO3,正确,答案选D。
本题难度:一般