1、选择题 将O2、NO、NH3、HCl分别收集于等体积的四个容器里,用导管把四个容器连成一个整体,若使各种气体充分混和(前后条件均相同),混和后容器中的压强与原容器中的?压强与原容器中的压强之比为
A.1:1
B.1:2
C.3:4
D.3:8
参考答案:D
本题解析:假设每个容器里都盛有2mol气体,混合前气体的物质的量为8mol,混合后,NH3、HCl恰好完全反应得到固体,2NO+O2 2NO2,所以氧气剩余1mol,生成二氧化氮2mol,容器中共剩余3mol气体,所以混合后的压强与混合前的压强之比为3:8。
2NO2,所以氧气剩余1mol,生成二氧化氮2mol,容器中共剩余3mol气体,所以混合后的压强与混合前的压强之比为3:8。
本题难度:一般
2、选择题 W、X、Y是原子序数依次增大的同一短周期元素。W、X是金属元素,它们的最高价氧化物对应水化物之间可以反应生成盐和水;Y的最外层电子数是核外电子层数的2倍,W与Y 可形成化合物W2Y。下列说法正确的是
[? ]
A.Y的某低价氧化物与O3漂白的原理相同
B.Y的氢化物和W2Y所含化学键的类型相同
C.上述三种元素形成的简单离子中,X的离子半径最小
D.工业上常用电解相应的盐溶液制备W、X的单质
参考答案:C
本题解析:
本题难度:一般
3、选择题 A、B、C、D为原子序数依次增大的同周期的短周期元素。已知A、C、D三种原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水。下列判断正确的是
[? ]
A.A、C、D三种元素的最高价氧化物对应的水化物有两种是强碱、一种是强酸或两种是强酸、一种是强碱
B.A、C、D三种元素有两种是金属、一种是非金属
C.D元素在第三周期第ⅥA族
D.A、B、C三种元素的单质熔沸点依次降低
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列各组元素原子结构递变情况错误的是
[? ]
A.Li、Be、B原子最外层电子数依次增多?
B.P、S、Cl元素最高正化合价依次增大
C.N、O、F原子半径依次增大?
D.Na、K、Rb的电子层数依次增多
参考答案:C
本题解析:
本题难度:一般
5、简答题 下表是元素周期表的一部分.
族
周期 | I?A | II?A | III?A | IV?A | V?A | VI?A | VII?A
一
|
二
a
b
?d
e
三
f
g
h
j
|
(1)表中元素的单质中熔点最高的可能是______(填元素符号);写出a的氯化物的电子式______;e、f、h形成的简单离子的半径由大到小顺序依次为______(填离子符号).
(2)在一定条件下,j与d可形成一种化合物,常温下为淡黄色液体,则其晶体类型为______.该物质遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形,另一种物质具有漂白性,写出相关反应的化学方程式______.
(3)现有一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,该元素是表中______元素(填编号).
(4)在g的单质中添加f单质,形成物质k,则g、f、k中硬度最大的是______(填物质名称).
(5)若制得117号元素,按元素周期表中金属与非金属的分区,它应是一种______(选填“金属”“非金属”)元素,写出117号元素最外层电子排布式______.
(6)试用短周期元素,写出两种中心原子杂化轨道类型不同的AB3型分子的化学式______、______.
参考答案:由元素在周期表中位置可知a为Li元素;b为C元素;d为N元素;e为F元素;f为Mg元素;g为Al元素;h为S元素;j为Cl元素.
(1)碳单质存在原子晶体,故碳元素单质熔点可能最高;氯化锂由锂离子与氯离子构成,电子式为
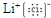
;电子层结构相同,核电荷数越大,离子半径越小,所以离子半径F->Mg2+,最外层电子数相同,电子层越多离子半径越大,所以离子半径S2->F-,所以离子半径S2->F->Mg2+;
故答案:C;
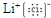
;S2->F->Mg2+;
(2)j与d形成化合物是NCl3,常温下为淡黄色液体,沸点较低,属于分子晶体.NCl3遇水强烈水解,生成两种产物,其中之一的分子构型为三角锥形为NH3,另一种物质具有漂白性是HClO,反应方程式为NCl3+3?H2O═NH3+3HClO,
故答案为:NCl3+3?H2O═NH3+3HClO;
(3)同周期自左而右,电负性增大,同主族自上而下,电负性减小.所以电负性最大是F元素,F原子获得一个电子所释放出能量最多,故答案为:e;
(4)合金的硬度高于各组分,所以铝镁合金硬度最大,故答案为:铝镁合金;
(5)第七周期0族元素为118号,所以117号元素处于第七周期第ⅦA族,最外层电子排布式为7s27p5,最外层电子数≤电子层数,属于金属元素,
故答案为:金属;7s27p5;
(6)AB3型分子可能为三角锥型,如NH3,N原子采取sp3杂化;也可能是平面三角形,如BF3,B原子采取sp2杂化,故答案为:NH3;BF3.
本题解析:
本题难度:一般