1、选择题 对下列事实的解释正确的是(?)
A.氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应
C.向50 mL 18 mol·L-1的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D.常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
参考答案:B
本题解析:氯气使湿润的有色布条褪色,是因为氯气与水反应生成的HClO具有漂白性,A错;4HF+SiO2 SiF4↑+2H2O,B正确;随着反应的进行,硫酸的浓度逐渐减小,而稀硫酸与铜不反应,所以被还原的H2SO4的物质的量<
SiF4↑+2H2O,B正确;随着反应的进行,硫酸的浓度逐渐减小,而稀硫酸与铜不反应,所以被还原的H2SO4的物质的量<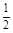 ×0.05 L×18 mol·L-1="0.45" mol,C错误;常温下,浓硝酸可以用铝制容器贮存,是因为常温下铝与浓硝酸发生了钝化,钝化是浓硝酸与铝反应,在铝表面生成了一层致密的氧化膜,D错。
×0.05 L×18 mol·L-1="0.45" mol,C错误;常温下,浓硝酸可以用铝制容器贮存,是因为常温下铝与浓硝酸发生了钝化,钝化是浓硝酸与铝反应,在铝表面生成了一层致密的氧化膜,D错。
本题难度:一般
2、填空题 下表是元素周期表的一部分,回答下列有关问题:
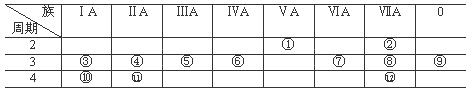
(1).写出下列元素符号:①______,⑥______,⑦ ________, _________ 。
_________ 。
(2).在这些元素中,最活泼的金属元素是_______,最活泼的非金属元素是________,最不活泼的元素是___________(用元素符号做答)。
(3).在这些元素的最高价氧化物对应水化物中,酸性最强的是_______(填化学式),碱性最强的是___________,呈两性的氢氧化物是__________,写出三者之间相互反应的化学方程式:_____________;_____________;_____________________。
(4).在这些元素中,原子半径最小的是__________(填元素符号),原子半径最大的是__________ 。
(5).在⑤与④中,化学性质较活泼的是________(填元素名称),设计两个原理不同的简单实验(只要写出实验方案即可),用化学实验证明。方案一:________________________;方案二:______________________ 。
(6).在⑧与⑦ 中,化学性质较活泼的是___________,写出可以验证该结论的一个离子反应方程式____________。
参考答案:(1)?N;Si;S;Ca
(2)?K;F;Ar
(3)?HClO4;KOH;Al(OH)3 ;3HClO4 + Al(OH)3 = Al(ClO4)3 + 3H2O;HClO4 + KOH = KClO4 + H2O ;
KOH + Al(OH)3 = KAlO2 + 2H2O
(4)?K;F
(5)Mg;?方案一:用Mg条和Al片分别和同浓度的盐酸反应反应,观察其反应速率的快慢;
方案二:分别向AlCl3溶液、MgCl2溶液中加入NaOH溶液,观察其沉淀及其溶解情况。(或其他合理答案)
(6)?氯; H2S + Cl2 = 2HCl + S↓
本题解析:
本题难度:一般
3、选择题 下列叙述中正确的是
[? ]
A.NH3、CO、CO2都是极性分子
B.CH4、CCl4都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2都是直线形分子
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列元素中,原子半径最大的是( )
A.Cl
B.Na
C.H
D.F
参考答案:Cl与Na同周期,核电荷数越大半径越小,所以原子半径Cl<Na.短周期元素半径最小的是:H,其次:F.
故选:B
本题解析:
本题难度:简单
5、选择题 下列叙述正确的是
A.核外电子排布完全相同的两种微粒的化学性质一定相同
B.单原子形成的离子一定具有稀有气体元素原子的核外电子排布
C.核外电子排布相同的两种原子一定属于同种元素
D.不存在质子数和电子数分别相同的阳离子和阴离子
参考答案:CD
本题解析:本题主要是通过微粒的核外电子排布来强化对质子和电子的数量关系的认识,并熟练掌握核外电子排布相同的原子、阴离子、阳离子的本质联系。核外电子排布完全相同的两种微粒可能是原子、阴离子、阳离子三种情况中的一种或者几种,如果是同一元素的两种核素,化学性质应该相同,如果不是同一元素的两种核素,其他符合题目要求的两种微粒的化学性质肯定不同,并且有的悬殊还很大,所以A选项是错误的;我们熟悉的元素的单原子形成的离子一般具有稀有气体元素原子的核外电子排布,但也有特例,如H+核外电子数是0,不存在电子数为0的稀有气体元素的原子,所以B选项是错误的;核外电子排布相同即电子数相同,又因为都是原子,所以质子数也相同,质子数相同的不同原子必定属于同位素关系,所以C选项是正确的;如果阴、阳离子的电子数相同,则其质子数必定不同,反之亦然,所以不存在质子数和电子数分别相同的阳离子和阴离子,D选项也是正确的。
本题难度:一般