|
|
|
高考化学知识点整理《化学平衡》高频试题强化练习(2017年最新版)(十)
2017-11-11 04:04:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下列说法不正确的是
[? ]
A.原电池负极被氧化
B.任何化学反应,只要化学反应的速率很快,理论上都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
参考答案:B
本题解析:
本题难度:一般
2、填空题 (14分)A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:
(1)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为 。
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式
;
(4)工业上在高温的条件下,可以用A2C与BC反应制取单质A2。在等体积的I、II两个密闭容器中分别充入1 molA2C和1mol BC、2 mol A2C和2 mol BC。一定条件下,充分反应后分别达到平衡(两容器温度相等)。下列说法正确的是 。
A.达到平衡所需要的时间:I>II
B.达到平衡后A2C的转化率:I=II
C.达到平衡后BC的物质的量:I>II
D.达到平衡后A2的体积分数:I<II
(5)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化
合物的溶液中构成电池,则电池负极反应式为 。
参考答案:(14分)
(1)8 mol(3分)
(2) HS-+OH-=S2-+H2O(2分)
(3) C(s)+ 1/2O2(g)=CO(g);△H= -(a-2b) kJ/mol(3分)
(4)A、B (4分)
(5)2Al+8OH- -6e-=2AlO2-+4H2O(2分)
本题解析:F元素的最外层电子数是次外层电子数的0.75倍,则F的次外层电子数不可能是2,所以F元素有3层电子,次外层电子数是8,最外层电子数是6,所以F是S元素;C、F分别是同一主族元素,则C是O元素;又知B元素的最外层电子数是内层电子数的2倍,则B的内层电子数不可能是10,即B元素不可能是3层电子,所以内层电子数是2,则B元素是C元素;E元素的最外层电子数等于其电子层数,则E可能是H、Be、Al;它们的原子序数依次增大,所以E是Al元素;A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,D元素只能在F、Na、Mg中选择,若D是F,则与O元素的质子数之和是17,则A元素不存在;若D是Na,则A是H元素;若D是Mg,则A是He,不是主族元素,所以A是H元素,D是Na元素。
(1)1 mol由E、F二种元素组成的化合物Al2S3跟由A、C、D三种元素组成的化合物NaOH反应,生成两种盐,这两种盐是硫化钠和偏铝酸钠,则反应的化学方程式为Al2S3+8NaOH=4H2O+2NaAlO2+3Na2S,所以完全反应后消耗氢氧化钠的物质的量为8mol;
(2)A、C、F间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲是HS-,乙是OH-,二者反应生成硫离子和水,离子方程式是HS-+OH-=S2-+H2O;
(3)1molC固体完全燃烧生成二氧化碳放出的热量是akJ,热化学方程式为C(s)+ O2(g)=CO2(g);△H=" -a" kJ/mol,14gCO的物质的量是14g/28g/mol=0.5mol,则1molCO完全燃烧生成二氧化碳放出的热量是2bkJ,热化学方程式是CO(s)+ 1/2O2(g)=CO2(g);△H=" -2b" kJ/mol,所以两式相减,得C固体与氧气反应生成CO的热化学方程式,为C(s)+ 1/2O2(g)=CO(g);△H= -(a-2b) kJ/mol;
(4)工业制取氢气的化学方程式为CO+ H2O H2+CO2,该反应是气体物质的量不变的可逆反应,所以I与II是等效平衡。A、因为II的反应物的浓度是I的2倍,所以反应物浓度增大,反应速率加快,则到达平衡的时间:I>II,正确;B、因为通入的反应物的 比是相同的,所以达到的平衡是等效平衡,达到平衡后A2C的转化率:I=II,正确;C、达到平衡后BC的物质的量,II是I的2倍,错误;D、达到平衡后A2的体积分数:I=II,错误,答案选AB; H2+CO2,该反应是气体物质的量不变的可逆反应,所以I与II是等效平衡。A、因为II的反应物的浓度是I的2倍,所以反应物浓度增大,反应速率加快,则到达平衡的时间:I>II,正确;B、因为通入的反应物的 比是相同的,所以达到的平衡是等效平衡,达到平衡后A2C的转化率:I=II,正确;C、达到平衡后BC的物质的量,II是I的2倍,错误;D、达到平衡后A2的体积分数:I=II,错误,答案选AB;
(5)C、Al、NaOH构成的原电池中,Al作负极,失去电子与氢氧化钠反应生成偏铝酸钠和水,所以负极的电极反应式为2Al+8OH- -6e-=2AlO2-+4H2O。
考点:考查元素的推断,物质的判断及性质应用,方程式的书写,电化学反应原理的应用
本题难度:困难
3、填空题 一密封体系中发生下列反应:N2 +3H2 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图: 2NH3 +Q,下图是某一时间段中反应速率与反应进程的曲线关系图:

回答下列问题:
(1)处于平衡状态的时间段是______.
(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?
、 、
(3)下列各时间段时,氨的百分含量最高的是______.
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6
|
参考答案:(1)t0~t1、t2~t4、t5~t6(2)升高温度,加了催化剂,降低压强(3)t0~t1
本题解析:本题是考查反应速率与化学平衡内在联系的一道好题.处于平衡状态时,正逆反应速率必定相等,从图(1)可看出t0~t1、t2~t4、t5~t6时间段时反应处于平衡状态.
t1时刻,条件变化使V正、V逆都加快,且V逆>V正,平衡向逆反应方向移动,对照反应式可看出条件变化应是“升高温度”.t3时刻,V正、V逆都同幅度加快,应是“加了催化剂”.t4时刻时,V正、V逆都减慢,且V正<V逆,平衡逆移,所以是由“降低压强”引起的.
由于t1~t2时间段和t4~t5时中,平衡都向逆反应方向移动,氨百分含量都减小,所以应是t0~t1时间段中氨百分含量最高。
考点:化学平衡
本题难度:一般
4、填空题 I.高炉炼铁的主要反应为Fe2O3+3CO2Fe+3CO2。
已知该反应的 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。 H,在1000℃时,K=64。在1000℃的条,在容积10 L的密闭容器中,加入Fe、Fe2O3、CO、CO2各1.OmoI,反应经10 min后达到平衡。
(1)该时间范围内的平均反应速率v(CO2)=_________mol/L min min
(2) 的最大转化率_________________。
(3)欲提高CO的平衡转化率,可采取的措施是_______________。
A.减少Fe的量
B.增加Fe2O3的量
C.升高反应温度
D.移出部分CO2
|
E.使用合适的催化剂? F.减少容器的容积
Ⅱ.已知化学反应①:Fe(s)+CO2(g)

FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)

FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
温度
| K1
| K2
|
973K
| 1.47
| 2.38
|
1173K
| 2.15
| 1.67
|
?
(4)通过表格中的数值可以推断:反应①的△H_
?O。(填“>”“<”)
(5)现有反应③:该反应的平衡常数的数学表
达式K3=____。
(6)根据反应①和②可以推导出Ki,Kz和玛之间的关系式。K3=__________。据此关系式和上表数据,也能推断出反应③的△H_
?_0(填“>”“<”)。
参考答案:(14分)
(1)0.006?(2分)
(2)60%?(2分)
(3)D?(2分)
(4)>?(2分)
(5) ?(2分)
?(2分)
(6)K3=K1/K2?(2分) >?(2分)
本题解析:I.⑴在1000℃时,该反应的平衡常数K=64,在10L恒容密闭容器甲中,加入物质反应达到平衡,设消耗一氧化碳物质的量为x
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol) 1? 1? 1? 1
变化量(mol)? x? x
平衡量(mol)? 1-x? 1+x
K=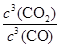 =
= =64,计算得到x=0.6
=64,计算得到x=0.6
转化率=60%
v(CO2)= =0.006mol/L
=0.006mol/L min
min
故答案为:⑴0.006mol/L min⑵60%;
min⑵60%;
⑶A.铁是固体,减少Fe的量,不影响平衡移动,CO的平衡转化率不变,故A错误;
B.氧化铁是固体,增加Fe2O3的量,不影响平衡移动,CO的平衡转化率不变,故B错误;
C.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故C错误;
D.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故D正确;
E.加入合适的催化剂,平衡不移动,故E错误;
F.反应前后气体的物质的量不变,减小容器的容积,增大压强平衡不移动,CO的平衡转化率不变,故F错误;
故选D;
⑷由表中数据可知,温度升高,①的平衡常数增大,说明平衡向正反应方向移动,则正反应吸热,△H?>0
故答案为:>;
⑸依据反应CO2(g)+H2(g) CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
,故答案为:
(6)已知:①Fe(s)+CO2(g) FeO(s)+CO(g);
FeO(s)+CO(g);
②Fe(s)+H2O(g) FeO(s)+H2(g);
FeO(s)+H2(g);
利用盖斯定律将①-②可得:③H2(g)+CO2(g) CO(g)+H2O(g);
CO(g)+H2O(g);
则K3= =
=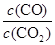 ÷
÷ =
=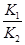 ;
;
依据图表平衡常数数据分析,温度升高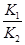 增大,说明平衡正向进行,反应是吸热反应;△H>0,
增大,说明平衡正向进行,反应是吸热反应;△H>0,
答案: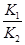 ,>。
,>。
本题难度:一般
5、填空题 (1)下列关于氧化物的各项叙述正确的是__ (填写序号)。
①酸性氧化物肯定是非金属氧化物
②非金属氧化物肯定是酸性氧化物
③碱性氧化物肯定是金属氧化物
④金属氧化物都是碱性氧化物
⑤酸性氧化物均可与水反应生成相应的酸
⑥与水反应生成酸的氧化物不一定是酸酐,与水反应生成碱的氧化物不一定是碱性氧化物
⑦不能跟酸反应的氧化物一定能跟碱反应
(2)下列元素一定为主族元素的是____。
①最高正价为+6,并且不能与氢形成气态氢化物
②最外层电子数为1,并且有+1、+2两种化合价
③除最外层外,其余各电子层都达到了饱和
④次外层电子数是最外层电子数的3倍
⑤最外层电子数为3的一种元素
⑥能形成气态氢化物的一种元素
⑦最高价氧化物对应的水化物是酸的一种元素
(3)已建立化学平衡的某可逆反应,改变条件,使化学平衡向正反应方向移动时,下列叙述正确的是
____。
①生成物的物质的量分数一定增加
②生成物总产量一定增加
③反应物的转化率一定增大
④反应物的浓度一定降低
⑤反应物的浓度一定增大
⑥正反应速率一定大于逆反应速率
⑦一定使用催化剂
(4)A、B、C是三种互不同族也不同周期的短周期元素,原子序数总和为26,它们可以形成一种三原子化合物,这种化合物的化学式是____。
参考答案:(1)③⑥
(2)④⑤⑥
(3)②⑥
(4)HClO
本题解析:
本题难度:一般
 FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其平衡常数K2.在温度973K和1173K情况下,K1、K2的值分别如下: ?(2分)
?(2分) 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)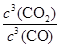 =
= =64,计算得到x=0.6
=64,计算得到x=0.6 =0.006mol/L
=0.006mol/L min
min min⑵60%;
min⑵60%; CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=
CO(g)+H2O(g),根据平衡常数的概念,该反应的平衡常数K3的数学表达式:K=

 FeO(s)+CO(g);
FeO(s)+CO(g); FeO(s)+H2(g);
FeO(s)+H2(g); CO(g)+H2O(g);
CO(g)+H2O(g); =
=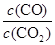 ÷
÷ =
=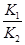 ;
;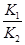 增大,说明平衡正向进行,反应是吸热反应;△H>0,
增大,说明平衡正向进行,反应是吸热反应;△H>0,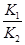 ,>。
,>。