1、填空题 化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的可燃冰是高压下形成的外观像冰的甲烷水合物固体,被称之为“未来能源”。在25?℃、101?kPa下,1?g甲烷完全燃烧生成CO2和液态水时放热55.6?kJ。甲烷燃烧的热化学方程式为_________________________________;相同条件下,356?g可燃冰(分子式为CH4 9H2O)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为___________?kJ。
9H2O)释放的甲烷气体完全燃烧生成CO2和液态水,放出的热量为___________?kJ。
(2)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。
①?写出一种与二甲醚相对分子质量相等且元素种类相同的有机物的结构简式________。
②?二甲醚可由合成气(CO和H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是:?_____________________________________________。
③?以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是:______________________________________________。
④?在容积固定的密闭容器中进行化学反应:CO(g)?+?H2O(g) CO2(g)?+?H2(g),其化学平衡常数K和温度T的关系如下表
CO2(g)?+?H2(g),其化学平衡常数K和温度T的关系如下表
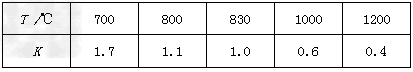
该反应的化学平衡常数表达式为K=____________________。该反应的正反应是__________反应(填“吸热”或“放热”)。
参考答案:(1)CH4(g)?+?2O2(g)?==?CO2(g)?+?2H2O(l);?△H=-8?89.6?kJ/mol;1779.2
(2)①?CH3CH2OH或HCOOH;
②3CO+3H2?==CH3OCH3?+?CO2或2CO+?4H2==?CH3OCH3+H2O;
③CH3OCH3?+?16OH--12e-?==?2CO32-+?11H2O;?
④K=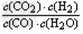 ;放热
;放热
本题解析:
本题难度:一般
2、简答题 氨是一种重要的化工原料,氨的合成和应用是当前的重要研究内容之一.
(1)传统哈伯法合成氨工艺中相关的反应式为:N2+3H2
2NH3 △H<0.
①该反应的平衡常数K的表达式为:K=______.升高温度,K值______(填“增大”“减小”或“不变”).
②不同温度、压强下,合成氨平衡体系中NH3的物质的量分数见下表(N2和H2的起始物质的量之比为1:3).分析表中数据,______(填温度和压强)时H2转化率最高,实际工业生产不选用该条件的主要原因是______.

③下列关于合成氨说法正确是______(填字母)
A.使用催化剂可以提高氮气的转化率
B.寻找常温下的合适催化剂是未来研究的方向
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利于提高H2的转化率
(2)最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法.它既有液氢燃料电池的优点,又克服了液氢不易保存的不足.其装置为用铂黑作为电极,加入电解质溶液中,一个电极通入空气,另一电极通入氨气.其电池反应为
4NH3+3O2=2N2+6H2O
你认为电解质溶液应显______?性(填“酸性”、“中性“、“碱性”),写出负极电极反应式______.
参考答案:(1)①根据化学方程式可写出平衡常数为k=c2(NH3)c(N2)?c3(H2),由于反应放热,升高温度平衡向逆反应方向移动,则平衡常数减小,
故答案为:k=c2(NH3)c(N2)?c3(H2);减小;
②200℃、100MPa时氨气的含量最大,则H2转化率最高,但实际工业生产中越强不能太大,因压强太高,对生产设备要求也高,难以实现,
故答案为:200℃、100MPa;压强太高,对生产设备要求也高,难以实现;
③A.催化剂不影响平衡移动,故A错误;
B.寻找常温下的合适催化剂可减少能量的消耗,为研究的主要方向,故B正确;
C.△S<0,需在一定温度下才能进行,故C错误;
D.增大n(N2)可提高H2的转化率,故D正确.
故答案为:BD;
(2)氨气为碱性气体,易与酸反应,所以电解质溶液应呈碱性,负极发生氧化反应,氨气被氧化生产氮气,电极反应式为2NH3-6e-+6OH-=N2+6H2O,
故答案为:碱性;2NH3-6e-+6OH-=N2+6H2O.
本题解析:
本题难度:一般
3、选择题 (双选)下列图示与对应的叙述不相符的是( ? )
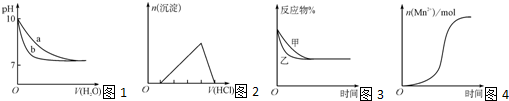
A.图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中b表示氨水稀释时pH的变化曲线
B.图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C.图3表示压强对可逆反应CO(g)+H2O(g)?CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D.图4表示10?mL?0.01?mol?L-1?KMnO4?酸性溶液与过量的0.1?mol?L-1?H2C2O4溶液混合时,n(Mn2+)?随时间的变化(Mn2+对该反应有催化作用)
参考答案:AB
本题解析:
本题难度:简单
4、选择题 将固体NH4I置于密闭容器中,在一定温度下发生下列反应: ①NH4I(s) NH3(g)+HI(g);
NH3(g)+HI(g);
②2HI(g) H2(g)+I2(g) 达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
H2(g)+I2(g) 达到平衡时,c(H2)=0.5mol·L-1,c(HI)=4mol·L-1,则此温度下反应①的平衡常数为
[? ]
A.9
B.16
C.20
D.25
参考答案:C
本题解析:
本题难度:一般
5、简答题 )氮元素有着多变价态和种类繁多的化合物,它们在工农业生产、生活中发挥着重要的作用.完成下列问题:
(1)在一密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与温度T的关系如下表:
| T | 298K | 398K | 498K | …
K
4.1×106
K1
K2
…
|
①比较K1、K2的大小:K1______K2(填“>”、“=”或“<”).
②若保持容器的容积不变,则该反应达到化学平衡状态的依据是______(填序号).
a.2v(H2)正=3v(NH3)逆b.v(N2)正=3v(H2)逆
c.容器内压强保持不变d.混合气体的平均摩尔质量保持不变
③若维持容器的压强不变,达到平衡状态后再向容器中通入一定量的N2,此时逆反应速率______(填“增大”、“减小”或“不变”);平衡向______方向移动.
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,则Ksp(AgCl)______Ksp(AgBr)(填“>”“=”或“<”).
(2)肼是氮元素的另一种氢化物,分子式为N2H4.
①298K时,1.00gN2H4(l)与足量的N2O4(l)完全反应生成氮气和水,放出19.15kJ的热量.写该反应的热化学方程式______.
②肼也可以在纯氧中燃烧生成氮气和水,为了充分利用其能量有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式______.
参考答案:(1)①N2(g)+3H2(g)?2NH3(g)△H<0,反应为放热反应,温度升高,化学平衡向着逆向移动,氨气浓度减小,氮气、氢气浓度增大,平衡常数减小,所以K1>K2,
故答案为:>;
②a.2v正(H2)=3v逆(NH3),表示正逆反应速率相等,达到了平衡状态,故a正确;
b.v正(N2)=3v逆(H2),表示的是正反应速率和逆反应速率,但是不符合化学计量数关系,所以正逆反应速率不相等,没有达到平衡状态,故b错误;
c.容器内压强保持不变,该反应两边气体的化学计量数之和不相等,气体的物质的量是个变量,而容器容积固定,所以压强不变,说明正逆反应速率相等,达到了平衡状态,故c正确;
d.混合气体的平均摩尔质量保持不变,反应方程式两边都是气体,所以气体的质量不变,而方程式两边气体的体积不相等,所以气体的物质的量是个变量,气体的平均摩尔质量不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:acd;
③若维持容器的体积不变,达到平衡状态后再向容器中通入一定量的N2,此时氨气的浓度不变,所以逆反应速率不变;氮气浓度增大,平衡向着氮气浓度减小的反应一定即平衡向着正向移动,
故答案为:不变;正反应;
④已知AgCl可溶于氨水中,而AgBr不溶于氨水中,溶解度越大,溶度积越大,所以氯化银的溶度积大于溴化银的溶度积,
故答案为:>;
(2)①N2H4(l)与足量的N2O4(l)完全反应生成氮气和水,根据化合价升降相等配平为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l),2mol肼的质量为64g,放出的热量为1225.6kJ,反应的热化学方程式为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol,
故答案为:2N2H4(l)+N2O4(l)═3N2(g)+4H2O(l)△H=-1225.6 kJ/mol;
③利用肼在纯氧中燃烧生成氮气和水设计成原电池,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,负极失去电子被氧化,所以负极反应为肼失去电子被氧化成氮气,电极反应为:N2H4-4e-═N2+4H+,
故答案为:N2H4-4e-═N2+4H+.
本题解析:
本题难度:简单