1、选择题 浓H2SO4在使下列物质的转化中,既表现出氧化性,又表现出酸性的是?
[? ]
A.Cu→CuSO4?
B.C→CO2
C.FeO→Fe2(SO4)3?
D.Fe2O3→Fe2(SO4)
参考答案:AC
本题解析:
本题难度:一般
2、选择题 下列钠的化合物在自然界中不存在的是
[? ]
A.氧化物
B.硫酸盐
C.氯化物
D.碳酸盐
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列说法正确的是(?)
A.只有链烃基与羧基直接相连的化合物才叫羧酸
B.饱和一元脂肪酸组成符合CnH2n-2O2
C.羧酸是一类酸,它们在常温下都呈液态
D.羧酸的官能团为—COOH
参考答案:D
本题解析:苯环直接与—COOH相连的化合物也是羧酸;羧酸是一类酸,有的呈液态,有的呈固态。
本题难度:简单
4、简答题 某老师取6.4g铜丝和12mL18mol/L浓硫酸按教材中“铜与浓硫酸反应”的实验装置进行实验.
(1)试管A中反应的方程式是______.
(2)试管B用来探究SO2的漂白性,则应装的试剂是______.
(3)试管C中的实验现象为______.
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g.则试管中余酸的物质的量浓度约为______(假设溶液体积不变).

参考答案:(1)铜和浓硫酸加热反应,浓硫酸具有强氧化性氧化铜为硫酸铜,本身被还原为二氧化硫,依据化学方程式的书写原则写出化学方程式:Cu+2H2SO4(浓)??△?.?CuSO4+SO2↑+2H2O;
?故答案为:Cu+2H2SO4(浓)??△?.?CuSO4+SO2↑+2H2O;?
(2)探究SO2的漂白性需要用品红,二氧化硫通入品红会褪色;
故答案为:品红;
(3)二氧化硫通入氯水中发生反应Cl2+SO2+2H2O=H2SO4+2HCl,所以氯水中氯气的淡黄绿色逐渐褪去;
故答案为:淡黄绿色逐渐褪去;
(4)反应结束后将铜丝取出,洗净、烘干,称量剩余铜丝的质量3.2g,说明反应了铜的质量为6.4g-3.2g=3.2g,物质的量为0.05mol,发生反应的化学方程式为:
Cu+2H2SO4(浓)??△?.?CuSO4+SO2↑+2H2O?消耗硫酸物质的量为0.1mol,所以剩余硫酸物质的量为0.216mol-0.1mol=0.116mol,剩余硫酸浓度=0.116mol0.012L=9.7mol/L;
故答案为:9.7mol/L;
本题解析:
本题难度:一般
5、简答题 某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验.
实验1:铜与浓硫酸反应,实验装置如图所示.
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为______.
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是:
______.
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是______.
实验2:实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜及氧化亚铜.
查阅资料:
①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.
②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行下图实验:
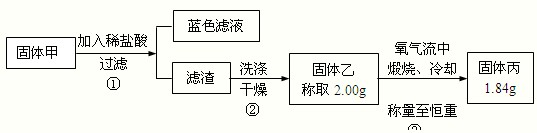
(4)过滤所需的玻璃仪器有______.
(5)②中检验滤渣是否洗涤干净的实验方法是______.
(6)③中在煅烧过程中一定存在的反应的化学方程式为______.
(7)下列对于固体甲的成分的判断中,正确的是(填字母选项)______.
A.固体甲中,CuS和Cu2S不能同时存在
B.固体甲中,CuO和Cu2O至少有一种
C.固体甲中若存在Cu2O,也可能有Cu2S
D.固体甲中若没有Cu2O,则一定有Cu2S.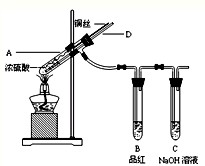
参考答案:(1)装置A中发生反应的化学方程式为2H2SO4(浓)+Cu ?△?.?CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu?△?.?CuSO4+SO2↑+2H2O;
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是试管A中气体压强减小,空气从D导管进入试管A中,
故答案为:试管A中气体压强减小,空气从D导管进入试管A中;
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中大量鼓气,
故答案为:从D管口向A中通入空气(鼓气);
(4)过滤用到的玻璃仪器有普通漏斗、烧杯、玻璃棒,故答案为:普通漏斗、烧杯、玻璃棒;
(5))②中检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体少许于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净,
故答案为:取最后一次洗涤后所得液体,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净;若有白色沉淀生成,则说明未洗干净;
(6)根据反应判断:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,则一定存在2CuS+3O2?△?.?2CuO+2SO2,
故答案为:2CuS+3O2?△?.?2CuO+2SO2;
(7)经分析固体甲加入稀盐酸后,得到的蓝色溶液,说明固体甲的成分中CuO和Cu2O至少有一种.
分析反应:Cu+O2=CuO 增重;Cu2S+2O2=2CuO+2SO2 不变;2CuS+3O2=2CuO+2SO2 减重,
因题给“固体乙称取2.00g,氧气流中煅烧、冷却称量至恒重,得固体丙1.84g”,即实际减重了,说明必有CuS,还要有其他物质.讨论:①若有Cu2O,Cu2S可有可无;②若无Cu2O,必有Cu2S.故③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2?△?.?2CuO+2SO2? (条件也可为“煅烧”).
经上分析,对于固体甲的成分的判断中,正确的是BCD,
故答案为:BCD.
本题解析:
本题难度:一般