1、选择题 A、B、C、D、E是短周期五种元素,其原子序数逐渐增大.其中A与C是同族元素,B、E两元素间可形成酸雨,B、D简单离子具有相同的核外电子排布结构.下列说法正确的是( )
A.氢化物的沸点:B<E
B.简单离子半径:B>D
C.元素A与元素B不能形成化合物A2B2,但元素B与C能形成化合物C2B2
D.元素D最高价氧化物一定能溶于强碱溶液
参考答案:A、B、C、D、E是短周期五种元素,其原子序数逐渐增大.其中A与C是同族元素,则A为H,C为Na;B、E两元素间可形成酸雨,则B为O,E为S;B、D简单离子具有相同的核外电子排布结构,则D可能为Mg或Al,
A.B为O,E为S,水中含有氢键,则沸点高,所以氢化物的沸点:B>E,故A错误;
B.B、D简单离子具有相同的核外电子排布,原子序数大的离子半径小,则D的离子半径小,故B正确;
C.元素A与元素B能形成化合物H2O2,元素B与C能形成化合物Na2O2,故C错误;
D.若D为Mg,则MgO不能溶于强碱,故D错误;
故选B.
本题解析:
本题难度:简单
2、填空题 X、Y、Z、R、W均为周期表中前四周期的元素,其原子序数依次增大;X2-和Y+有相同的核外电子排布;Z的气态氢化物的沸点比其上一周期同族元素气态氢化物的沸点低;R的基态原子在前四周期元素的基态原子中单电子数最多;W为金属元素,X与W形成的某种化合物与Z的氢化物的浓溶液加热时反应可用于实验室制取Z的气体单质。回答下列问题(相关回答均用元素符号表示):
(1)R的基态原子的核外电子排布式是____________。
(2)Z的氢化物的沸点比其上一周期同族元素氢化物的沸点低的原因是________________________________________________________________________。
(3)X与Z中电负性较大的是________。Z的某种含氧酸盐常用于实验室制取X形成的单质,此酸根离子的空间构型为________,此离子中所含化学键的类型是________,X—Z—X的键角________109°28′(填“>”、“<”或“=”,已知:孤电子对之间的斥力>孤电子对与成键电子对之间的斥力>成键电子对之间的斥力)。
(4)X与Y形成的化合物Y2X的晶胞如图。其中X离子的配位数为________,与一个X离子距离最近的所有的Y离子为顶点的几何体为________。该化合物与MgO相比,熔点较高的是________。
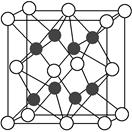
(5)已知该化合物的晶胞边长为a pm,则该化合物的密度为________g·cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA)。
参考答案:(1)1s22s22p63s23p63d54s1或[Ar]3d54s1
(2)HF分子间存在氢键,而HCl分子间不存在氢键
(3)O 三角锥形 共价键(或极性键、配位键均可) <
(4)8 立方体或正方体 MgO
(5)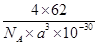
本题解析:(1)依据洪特规则可推知前四周期中基态原子中单电子数最多也即价层电子排布式为3d54s1(单电子数为6),则R为铬元素,其基态原子核外电子排布式为1s22s22p63s23p63d54s1或[Ar]3d54s1。(2)结合题干信息可推知元素X、Y、Z、W分别为O、Na、Cl、Mn;因HF分子间存在氢键,而HCl分子间不存在氢键,故沸点:HF>HCl。(3)O与Cl中电负性较大的是O;Cl的含氧酸盐中用于实验室制取氧气的盐为KClO3,ClO3-的价层电子对数为4(3个σ键、1个孤电子对),故ClO3-的空间构型(VSEPR模型为四面体)为三角锥形;ClO3-中Cl、O间为共价键,由于中心原子上存在一对孤电子对,孤电子对的排斥力大于成键电子对,故O—Cl—O的键角小于109°28′。(4)由晶胞结构可知O2-(晶胞中空心球)的配位数为8;与一个O2-距离最近的Na+为顶点形成的几何体为立方体;由于Mg2+所带电荷数比Na+多,且离子半径小于Na+的离子半径,因此MgO的晶格能大于Na2O的,则熔点:MgO>Na2O。(5)利用“均摊法”可知一个晶胞中含有4个Na2O微粒,故该化合物的密度为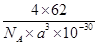 ?g·cm-3(注:1 pm=10-10 cm)。
?g·cm-3(注:1 pm=10-10 cm)。
本题难度:一般
3、填空题 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:
2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
⑴X基态原子的电子排布式为?。
⑵C、H、O三种原子的电负性由大到小的顺序为?。
⑶X2Cl2·2CO·2H2O是一种配合物,其结构如图所示:
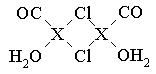
①与CO为互为等电子体的分子是?。
②该配合物中氯原子的杂化方式为?。
③在X2Cl2·2CO·2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键?。
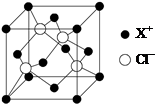
⑷XCl的晶胞如图所示,距离每个X+最近的Cl—的个数为?。
参考答案:
⑴1s22s22p63s23p63d104s1或[Ar] 3d104s1
⑵O>C>H
⑶①N2
②sp3
③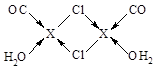
⑷4
本题解析:(1)X电子排布式为1s22s22p63s23p63d104s1,是铜元素;(2)非金属性越强电负性越大,所以为O>C>H;(3)①N2;②根据图示观察,每个氯原子有7个电子与铜的1个电子行成共价键,与另一个铜原子形成配位键,共有4个价电子对,故为sp3杂化;③碳、氧均有孤对电子,形成配位键如上图所示。(4)图示晶胞中不能观察到完成的X成键,但根据Cl原子的成键情况判断X情况,图中观察到每个Cl原子周围有4个X距离最近,因XCl个数比为1:1,故距离每个X+最近的Cl—的个数是4个。
本题难度:一般
4、选择题 下列事实能证明氯化氢是共价化合物的是(?)
A.氯化氢易溶于水
B.氯化氢水溶液能导电
C.液态氯化氢不导电
D.氯化氢不易分解
参考答案:C
本题解析:共价键在熔融状态下是不能断键的,即不能电离出离子。而离子键在熔融状态下能够电离出离子,可以导电,据此可用鉴别,答案选C。
点评:该题是基础性试题的考查,难度不大。该题的关键是明确实验原理,然后灵活运用即可,有利于培养学生规范严谨的实验设计能力。
本题难度:一般
5、填空题 我国已启动的“西气东输”工程是为了改善我国东部的能源结构,其中的“气”是指天然气,其主要成分的分子的电子式为__________,结构式为___________;分子里各原子的空间分布呈_________结构。
参考答案: ;正四面体
;正四面体
本题解析:
本题难度:一般