1、选择题 FeCl3的水解方程式可写为FeCl3+3H2O  Fe(OH)3+3HCl,若提高水解程度采取的方法是 (? )
Fe(OH)3+3HCl,若提高水解程度采取的方法是 (? )
A.降低温度
B.加入少量Na2CO3
C.加入少量盐酸
D.增加FeCl3的浓度
参考答案:B
本题解析:盐的水解反应是酸碱中和反应的逆反应。由于酸碱中和反应为放热反应,所以盐的水解反应是吸热反应。A.降低温度根据平衡移动原理,平衡会向放热反应方向即向逆反应方向移动,盐的水解程度减小。错误。B.加入少量Na2CO3。由于Na2CO3是强碱弱酸盐,水解使溶液显碱性,此时该盐水解产生的OH-会消耗FeCl3的水解产生的H+,由于减小了生成物的浓度,平衡正向移动,FeCl3的水解程度增大。正确。C.加入少量盐酸,c(H+)增大,由于生成物的浓度增大,平衡逆向移动,FeCl3水解程度减小。错误。D.增加FeCl3的浓度,增大了反应物的浓度,平衡正向移动,但由于平衡移动的趋势是很微弱的,投入量原大于平衡移动消耗量,所以FeCl3的水解程度反而减小。错误。
本题难度:一般
2、选择题 下列有关盐类水解的说法不正确的是()
A.盐类的水解过程破坏了纯水的电离平衡
B.盐类的水解是酸碱中和反应的逆反应
C.盐类水解的结果使盐溶液不一定显中性
D.Na2CO3溶液中c(Na+)是c( )的2倍
)的2倍
参考答案:D
本题解析:由于 水解,故c(Na+)>2c(
水解,故c(Na+)>2c( )。
)。
本题难度:简单
3、选择题 下列比较中,正确的是(?)
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.0.2 mol ·L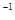 NH4Cl和0.1 mol·L
NH4Cl和0.1 mol·L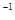 NaOH溶液等体积混合后:c(NH
NaOH溶液等体积混合后:c(NH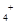 )>c(Cl
)>c(Cl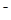 )>c(Na
)>c(Na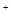 )>c(OH
)>c(OH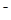 )>c(H
)>c(H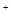 )
)
C.同浓度的下列溶液中,①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH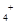 )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
D.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na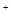 )+c(H
)+c(H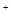 )=c(S
)=c(S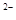 )+c(HS
)+c(HS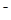 )+c(OH
)+c(OH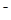 )
)
参考答案:C
本题解析:
正确答案:C
A.不正确, HF比HCN易电离,则NaF溶液的水解能力小,pH比NaCN溶液小。
B.不正确,等体积混合后相当于NH4Cl与NH3·H2O、NaCl等物质的量混合:c(Cl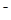 )>c(NH
)>c(NH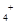 )> c(Na
)> c(Na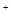 )>c(OH
)>c(OH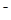 )>c(H
)>c(H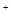 )
)
C.正确,同浓度的下列溶液中,①NH4Al(SO4)2的Al3+水解后生成的H+抑制NH4+?的水解、②NH4Cl、③CH3COONH4中(CH2)3COO―水解后促进NH4+的水解、④NH3·H2O是弱电解质,难电离;c(NH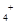 )由大到小的顺序是:①>②>③>④
)由大到小的顺序是:①>②>③>④
D.不正确,物质的量浓度相等的H2S和NaHS混合溶液中,存在电荷守恒:c(Na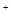 )+c(H
)+c(H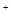 )=2c(S
)=2c(S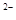 )+c(HS
)+c(HS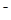 )+c(OH
)+c(OH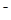 )
)
本题难度:一般
4、选择题 为配置NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入
[? ]
① 适量HCl ② 适量NaCl ③ 适量氨水 ④ 适量NaOH
A.①②
B.③
C.③④
D.④
参考答案:B
本题解析:
本题难度:一般
5、选择题 为了避免电解液中CuSO4因水解发生沉淀,正确的操作方法是? (? )
?
A.稀释
B.加稀硫酸
C.加NaOH溶液
D.加热
参考答案:B
本题解析:CuSO4因水解,溶液呈酸性:Cu2++2H2O Cu(OH)2+2H+,故可向其溶液中加入稀硫酸,抑制其水解即可,故选B
Cu(OH)2+2H+,故可向其溶液中加入稀硫酸,抑制其水解即可,故选B
本题难度:简单