1、填空题 (4分)盐碱地(含较多NaCl、Na2CO3)不利于作物生长,通过施加适量石膏可以降低土壤的碱性。试用化学方程式分别表示盐碱地产生碱性的原因:?,及用石膏降低其碱性的反应原理:?。
参考答案:(4分) Na2CO3 + H2O= NaOH+NaHCO3?Na2CO3 +CaSO4= Na2SO4+CaCO3↓
本题解析:碳酸钠是强碱弱酸盐,溶于水水解显碱性,水解方程式是Na2CO3 + H2O= NaOH+NaHCO3;石膏是硫酸钙,能和碳酸钠反应生成难溶性的碳酸钙沉淀,从而抑制水解,反应的化学方程式是Na2CO3 +CaSO4= Na2SO4+CaCO3↓。
点评:本题关键是要从平衡的角度去理解如何降低溶液的酸碱性,因此要利用勒夏特例原理。
本题难度:简单
2、选择题 在蒸发皿中用酒精灯加热蒸干下列物质的溶液然后灼烧,可得到该物质固体的是(?)
A.Al2(SO4)3
B.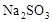
C.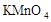
D.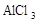
参考答案:A
本题解析:硫酸铝水解生成氢氧化铝和硫酸,硫酸不挥发,所以蒸干硫酸铝溶液得到硫酸铝固体;亚硫酸钠溶液加热蒸干过程中亚硫酸钠被氧化成硫酸钠,高锰酸钾溶液加热蒸干过程中高锰酸钾发生分解;氯化铝水解生成氢氧化铝和盐酸,盐酸挥发,所以加热蒸干氯化铝溶液得到氢氧化铝甚至温度过高可能得到氧化铝。
点评:盐溶液蒸干过程中要考虑到水解、分解、氧化等情况。
本题难度:一般
3、选择题 下列说法正确的是
A.相同物质的量浓度的下列溶液:①NH4Al(SO4)2、②NH4Cl、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的顺序是:①>②>③>④
B.某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,则该溶液的pH一定为14-a
C.物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c(Na+) = 2c(S2-) +2c(HS-)+2c(H2S)
D.常温下,若0.1mol/L NaHY溶液的pH=4,该溶液中粒子浓度关系为:c(Na+)>c(HY-)> c(Y2-) > c(H+)> c(H2Y)
参考答案:A
本题解析:铝离子水解显酸性,所以能抑制NH4+水解。醋酸根水解显碱性,能促进NH4+水解,所以选项A正确。B中说明水的电离是被抑制的,则溶液可能显酸性,也可能显碱性,B不正确。C不正确,应该是2c(Na+) = c(S2-) +c(HS-)+c(H2S)。0.1mol/L NaHY溶液的pH=4,说明电离程度大于水解程度,所以应该是c(Y2-)< c(H+),D不正确,答案选A。
本题难度:一般
4、填空题 (9分)某二元酸H2A在水中的电离方程式:H2A==H++HA-;HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显?(填“酸性”、“中性”或“碱性”)。理由是
___________________________________________(用离子方程式表示)
(2)在0.1 mol/L的Na2A溶液中,下列离子浓度关系不正确的是?。
A.c(A2-)+c(HA-)=0.1 mol/L
B.c(H+)=c(OH-)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)