1、实验题 (共12分)在容积固定为2L的密闭容器中,充入0.180 molHI,480℃时反应:
2HI(g) H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
H2(g)+I2(g),体系中n(HI)随时间变化情况如下表:
t/min
| 0
| 2
| 4
| 6
| 8
| 10
|
n(HI)/mol
| 0.180
| 0.164
| 0.152
| 0.144
| 0.140
| 0.140
|
反应进行至10min后将反应混合物的温度降低,发现气体的颜色变浅。
(1)0~2min内H2的平均反应速度为?。达平衡时,HI的转化率是_________。(2)上述正向反应是:?反应(选填:放热、吸热)。
(3)某温度下上述反应平衡时,恒容、升高温度,原化学平衡向?反应方向移动(填“正”或“逆”),正反应速率?(填“增大”、“减小”或“不变”),容器内混合气体的压强?(填“增大”、“减小”或“不变”)。
(4)480℃时,反应H2(g)+I2(g) 2HI(g)的平衡常数K的值为?。
2HI(g)的平衡常数K的值为?。
(5)要增大反应2HI(g) H2(g)+I2(g)的平衡常数,可采取的措施是?(选填字母)。
H2(g)+I2(g)的平衡常数,可采取的措施是?(选填字母)。
A.增大HI起始浓度
B.向混合气体中通入I2
C.使用高效催化剂?
D.升高温度
参考答案:(1)0.002mol/(L·min),22.2%?(2)吸热
(3)正,增大,增大。?(4)1/49? 5)D
本题解析:(1)0~2min内HI的速率为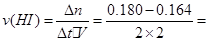 0.004mol/(L·min),由各物质的系数比可推出,
0.004mol/(L·min),由各物质的系数比可推出,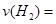 0.002mol/(L·min);
0.002mol/(L·min);
由表格中数据可知,反应到8分钟时,HI的浓度不再改变,即反应已经达到平衡,此时HI的转化率为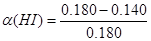 =22.2%
=22.2%
(2)由题意知,可逆反应2HI(g) H2(g)+I2(g)降温时碘蒸气浓度减小,平衡左移,正反应为吸热反应
H2(g)+I2(g)降温时碘蒸气浓度减小,平衡左移,正反应为吸热反应
(3)升温时,平衡向吸热反应方向移动,即正向移动;正逆反应速率均增大;由于两边气体系数相等,混合气体的总物质的量并不改变,但温度升高,由PV=nRT可知,压强增大
(4)由平衡常数的定义可知,在480℃时,K= 1/49
1/49
(5)K只与温度有关,升温平衡右移,K增大,故答案为D
本题难度:一般
2、选择题 可逆反应 2A ( 气) + 3B ( 气)  2C (气) + D(气),在四种不同条件下反应速率最快的是
2C (气) + D(气),在四种不同条件下反应速率最快的是
[? ]
A.VA = 0.5mol/(L·min)
B.VB = 0.6mol/(L·min)
C.VC = 0.35mol/(L·min)
D.VD = 0.4mol/(L·min)
参考答案:D
本题解析:
本题难度:简单
3、选择题 相同温度下,体积均为0.25?L的两个恒容密闭容器中发生可逆反应: X2(g)?+?3Y2(g)? ?2XY3(g)?△H=-92.6?kJ·mol-1 实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是
?2XY3(g)?△H=-92.6?kJ·mol-1 实验测得反应在起始、达到平衡时的有关数据如下表所示:下列叙述不正确的是

[? ]
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ ?
C.达平衡时,两个容器中XY3的物质的量浓度均为2?mol·L-1
D.若容器①体积为0.20?L,则达平衡时放出的热量大于23.15?kJ
参考答案:B
本题解析:
本题难度:一般
4、填空题 一定温度下,将3molA气体和1molB气体通过一密闭容器中,发生如下反应:3A(g)+B(g) xC(g)。
xC(g)。
请填写下列空白:
(1)若容器体积固定为2L,反应1min时测得剩余1.8molA,C的浓度为0.4mol/L。
①1min内,B的平均反应速率为_________;x_________;
②若反应经2min达到平衡,平衡时C的浓度_________0.8mol/L(填“大于”、“等于”或“小于”);
③平衡混合物中,C的体积分数为22%,则A的转化率是_________;
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式_________。
(2)若维持容器压强不变
①达到平衡时C的体积分数_________22%,(填“大于”、“等于”或“小于”);
②改变起始物质加入的量,欲使反应达到平衡时C的物质的量是原平衡的2倍,则应加入_________molA气体和_________molB气体
参考答案:(1)①0.2 mol/(L·min);2;②小于;③36%;④n(A)+3n(C)/2=3、n(B)+ n(C)/2=1
(2)①大于;②6mol;2mol
本题解析:
本题难度:一般
5、填空题 煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:
CO(g)+H2O(g)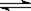 ?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
?CO2(g)+H2(g)的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| 0.6
|
试回答下列问题:(1)上述反应的正反应是?反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率?
(填“增大”、“减小”或“不变”),容器内混合气体的压强?(填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有?(选填A、B、C、D)。
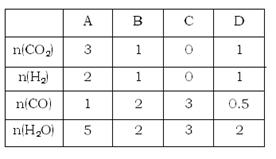
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是?。
参考答案:(每空2分,共10分)(1)放热(2分)?(2)增大(2分);增大(2分)
(3)B、C(2分,选一个且正确给1分,有错选不给分)?(4)60%(2分)
本题解析:(1)根据表中数据可知,随着温度的升高,平衡常数逐渐减小。这说明升高温度,平衡向逆反应方向移动,因此正反应是放热反应。
(2)保持容器体积不变升高温度,正反应速率增大,但逆反应速率增大的程度更大,所以平衡向逆反应方向移动。由于气体的物质的量是不变的,但温度升高,所以容器内气体的压强增大。
(3)根据表中数据可知,选项C中由于没有生成物,所以反应一定是向正反应方向进行的。而选项A、B、D中此时离子积分别是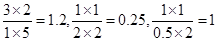 。由于830℃是平衡常数是1,所以选项A是向逆反应方向进行的,B是向正反应方向进行的,而D恰好是平衡状态,答案选BC。
。由于830℃是平衡常数是1,所以选项A是向逆反应方向进行的,B是向正反应方向进行的,而D恰好是平衡状态,答案选BC。
(4)设达到平衡时,CO的转化率是x,则消耗CO和水蒸气都是4x,而生成CO2和氢气都是4x,所以根据平衡常数表达式可知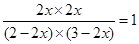 ,解得x=60%。
,解得x=60%。
本题难度:一般