1、选择题 绿色化学对于化学反应提出了“原子经济性”的新概念及要求。理想的原子经济性反应是原料中的原子全部转变成所需产物,不产生副产物,实现零排放。下列几种生产乙苯( )的方法中,原子经济性最好的是(反应均在一定条件下进行)
)的方法中,原子经济性最好的是(反应均在一定条件下进行)
[? ]
A.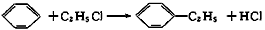
B.
C.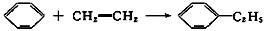
D.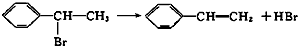
参考答案:C
本题解析:
本题难度:简单
2、实验题 (1)合成氨工业对化学工业和国防工业具有重要意义。工业合成氨生产示意图如图甲所示。
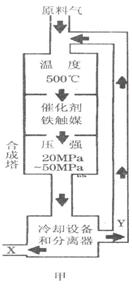
①X的化学式为__________,属于________(填“极性”或“非极性”)分子。
 ②图甲中条件选定的主要原因是(选填字母序号,下同)________。
②图甲中条件选定的主要原因是(选填字母序号,下同)________。
A.温度、压强对化学平衡的影响
B.铁触媒在该温度时活性大
C.工业生产受动力、材料、设备等条件的限制
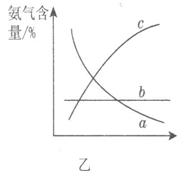
③改变反应条件,会使平衡发生移动。图乙表示随条件改变,氨气的百分含量的变化趋势。当横坐标为压强时,变化趋势正确的是________,当横坐标为温度时,变化趋势正确的是__________。
(2)常温下氨气极易溶于水,其水溶液可以导电。
①用方程式表示氨气溶于水的过程中存在的可逆反应:
___________________________________________________________________。
②氨水中水电离出的c(H+)___________10-7 mol/L(填“>”、“<”或“=”)。
③将氨水和盐酸混合后, 某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)?B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-)?D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
Ⅰ、若溶液中只溶解了一种溶质,该溶质的名称是?,上述离子浓度大小顺序关系中正确的是(选填序号)?。
Ⅱ、若上述关系中C是正确的,则溶液中溶质的化学式是?。
Ⅲ、若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前
c(HCl)?c(NH3·H2O)(填“>”、“<”、或“=”,下同),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)?c(Cl-)。
(3)氨气具有还原性,在铜的催化作用下,氨气和氟气反应生成X和Y两种物质。X为铵盐,Y在标准状况下为气态。在此反应中,若每反应1体积氨气,同时反应0.75体积氟气;若每反应8.96 L氨气(标准状况),同时生成0.3 mol X。
①写出氨气和氟气反应的化学方程式: ___________________________________。
②在标准状况下,每生成1 mol Y,转移电子的物质的量为___________mol。
(4)已知液态NH3与H2O相似,也可以发生微弱的电离,电离出含有相同电子数的微粒,则液态NH3的电离方程式为:?
参考答案:(1) ①NH3 (1分)?极性 (1分)?②B、C (2分)?③c (1分)? a (1分)
(2) ①NH3 + H2O 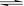 ?NH3·H2O
?NH3·H2O 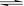 ?NH4+ + OH-? (2分)?;②< (1分)?
?NH4+ + OH-? (2分)?;②< (1分)?
(3)Ⅰ、氯化铵 ,A?(各1分);Ⅱ、NH4Cl和HCl(1分);Ⅲ、< ,=(各1分)
(4) ①4NH3 + 3F2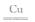 NF3 + 3NH4F (2分)?②6 (2分)
NF3 + 3NH4F (2分)?②6 (2分)
(5)2NH3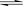 ?NH4++ NH2-?(2分)
?NH4++ NH2-?(2分)
本题解析:略
本题难度:简单
3、填空题 斯坦福大学R M. Trost教授提出了绿色化学的核心概念-原子经济性。我们常用原子利用率来衡量化学反应过程的原子经济性,其计算公式为:
原子利用率=
下面是新型自来水消毒剂ClO2的四种制取方法,请填空:
(1)氯酸钠和盐酸法:本方法的化学方程式为2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O,此方法的原子利用率为________%(保留一位小数)。
(2)电解亚氯酸钠法:本方法是用惰性电极电解亚氯酸钠溶液,原子利用率为62. 2%,其阳极的电极反应式为ClO2--e- ==ClO2↑,阴极的电极反应式为____。
(3)亚氯酸钠和氯气法:本方法的原子利用率为53. 6%,此反应的化学方程式为___。
(4)联合工艺法:本方法的反应原理由三步组成。
①电解热的氯化钠溶液:NaCl+3H2O NaClO3+3H2↑
NaClO3+3H2↑
②氢气和氯气合成氯化氢
③生成二氧化氯: 2NaClO3+4HCl==2NaCl+2ClO2↑+Cl2↑+2H2O
此方法的原子利用率最大为______%(保留一位小数)。
参考答案:(1)37.6
(2)2H++2e-==H2↑(或2H2O+2e-==H2↑+2OH-)
(3)2NaClO2+Cl2=2NaCl+2ClO2
(4)94.4
本题解析:
本题难度:一般
4、计算题 在给定温度下发生下述反应:4FeS2(s)+11O2(g)====2Fe2O3(s)+8SO2(g)? ΔH="-3" 319 kJ/mol,又知反应后的固体残渣中含有4%的FeS2,试计算燃烧1kg这种硫铁矿时放出的热量。
参考答案:5674.8 kJ。
本题解析:设参加反应的FeS2的质量为x,生成Fe2O3是2/3x。
(1-x)=4%(2/3x+1-x),
x="2.88/2.96" kg,
放出的热量=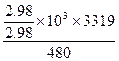 kJ="5674.8" kJ
kJ="5674.8" kJ
本题难度:简单
5、填空题 对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法:
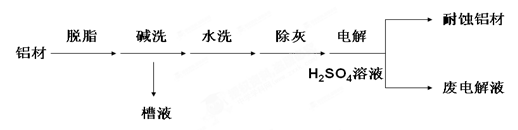
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 ?
(用离子方程式表示);
往废电解液中加入NaHCO3时会出现气泡,原因是?(用离子方程式表示)
(2)为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的?
A.NH3
B.CO2
C.NaOH
D.HNO3