|
高考化学必考知识点《原电池原理》在线测试(2017年最新版)(二)
2017-11-11 04:18:25
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 下图为一种新型的生物燃料电池,它有两个涂覆着酶的电极,处于充满空气和少量氢气的玻璃槽中,由于气体可以混合从而省去了昂贵的燃料隔离膜。下列对其工作原理叙述正确的是( )
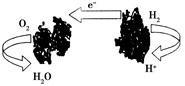
A.该电池工作过程中,H+浓度不断增大
B.该电池在高温环境下能提供更好的动力
C.该电池负极反应为:H2-2e-=2H+
D.该电池正极反应为:O2+4e-=2O2-
|
参考答案:C
本题解析:根据信息该电池反应方程式为2H2+O2=2H2O,在生物体中,H2O为稳定产物,则正极反应式为O2+2H2O+4e-=4OH-,负极反应式为2H2-4e-=4H+,H+生成量与消耗量相同,则反应过程中,H+浓度不变;由于酶受热易发生变性,而失去催化效果。
本题难度:一般
2、实验题 (13分)某课外小组探究钠、铝、铁、铜单质还原性强弱及其相关化学性质,做了如下实验:
实验1
| 常温时取四种金属少量分别放入装有蒸馏水的试管中
| 实验2
| 再取少量铝、铁、铜分别放入装有稀硫酸的试管中
|
(1)实验1中能发生反应的离子方程式 。
(2)实验2中能够判断出铝、铁、铜还原性强弱的现象是 。
结论:由实验1、2得出四种金属的还原性强弱顺序为 ;请从原子结构角度解释钠的还原性强于铝 。
(3)为确认实验2反应后溶液中的金属阳离子,再进行实验:
①取Al反应后的溶液加入过量的NaOH溶液,写出反应的离子方程式 。
②一段时间后,取Fe反应后的溶液,检验Fe2+方法正确的是 。
a.滴加KSCN溶液,无明显变化,再加入少量氯水,溶液变红
b.滴加K3[Fe(CN)6]溶液,有蓝色沉淀产生
c.滴加NaOH溶液,产生的白色沉淀迅速变成灰绿色,最终变成红褐色
(4)在实验2中,铝、铁反应现象的差异并不是很明显,有同学建议再设计一种实验来证明这两种金属的还原性关系,请设计一种实验方案 。
(5)在实验过程中,还有同学为了验证铁与铜的还原性,用铁、铜、导线、烧杯、氯化铁溶液设计了原电池装置。
①画出原电池的装置图 。
②该电池的正极反应为 。
参考答案:(13分)
(1)2Na+2H2O=2Na++2OH-+H2↑ (2分)
(2)铝、铁均产生气泡且铝稍快些,铜不产生气泡 (1分)
Na>Al>Fe>Cu (1分)
Na、Al同属于第三周期Na原子半径大于Al (1分)
(3)① Al3++4OH-=AlO2-+2H2O (2分)
②b (1分)
(4)将铝条插入硫酸亚铁溶液溶液中,溶液颜色变浅,铝条变粗(其它答案合理给分) (2分)
(5)① ②2Fe3++2e-=2Fe2+ (1分) ②2Fe3++2e-=2Fe2+ (1分)
本题解析:(1)钠、铝、铁、铜四种金属中常温下只有钠与水反应,反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(2)铝、铁与稀硫酸反应生成氢气且铝快些,铜与稀硫酸不反应;结论:由实验1、2得出四种金属的还原性强弱顺序为Na>Al>Fe>Cu;Na、Al同属于第三周期Na原子半径大于Al,钠更易失去电子;(3)①Al3+与过量的NaOH溶液反应的离子方程式Al3++4OH-=AlO2-+2H2O ;②通常可用K3[Fe(CN)6]溶液检验Fe2+,简便易操作,答案选b;(4)可通过原电池原理,氧化还原反应原理进行检验;(5)①应用Fe作负极,铜作正极,氯化铁溶液作电解质溶液,装置图略;②该电池的正极发生还原反应,电极反应为2Fe3++2e-=2Fe2+。
考点:常见金属的性质、原电池原理
本题难度:困难
3、选择题 下列装置中,溶液均为稀硫酸,可以构成原电池的是( )
A.
B.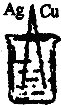
C.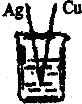
D.
参考答案:原电池的构成条件是:①有两个活泼性不同的电极,②将电极插入电解质溶液中,③两电极间构成闭合回路,④能自发的进行氧化还原反应.
A.锌和铜在稀硫酸溶液中形成原电池反应,锌做负极,铜做正极,该装置能自发的进行氧化还原反应,所以能构成原电池,故A正确;
B.铜和银与稀硫酸不反应,不能自发的进行氧化还原反应,该装置不符合原电池构成条件,所以不能构成原电池,故B错误;
C.铜和银与稀硫酸不反应,不能自发的进行氧化还原反应,该装置不符合原电池构成条件,所以不能构成原电池,故C错误;
D.该装置不能构成闭合回路,所以不能构成原电池,故D错误;
故选:A.
本题解析:
本题难度:简单
4、简答题 请从如图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气.

(1)A极发生的电极反应式是______B极发生的电极反应式是______
(2)设计上述气体实验装置时,各接口的正确连接顺序为:A接______、______接______;B接______、______接______.
(3)证明产物中有Cl2的实验现象是______.
(4)已知电解后测得产生的H2的体积为44.8mL(已经折算成标准状况),电解后溶液的体积为50mL,此时溶液中NaOH的物质的量浓度为______.
(5)有一和电解饱和食盐水能量转换相反的装置中,一极通入甲烷,另一极通入氧气,电解质溶液为KOH溶液,负极的反应式为______正极的反应式为______.
参考答案:(1)电解饱和食盐水获得氯气时,A极是活泼金属电极,应为阴极,阴极上是氢离子得电子,
反应式为:2H++2e-=H2↑,B极是阳极,阳极是氯离子失电子的过程,反应式是:2Cl--2e-=Cl2↑,
故答案为:2H++2e-=H2↑;2Cl--2e-=Cl2↑;
(2)测定产生的氢气的体积用排水量气法,导管是短进长出,所以A接G,用装有淀粉碘化钾溶液的洗气瓶检验氯气时,导管要长进短出,所以B接D,氯气要进行尾气处理,即E接C,故答案为:G、F、H、D、E、C;
(3)氯气可以将碘化钾中的碘置换出来,生成的碘单质可使使湿润的淀粉碘化钾试纸变蓝,所以证明产物中有Cl2的实验现象是湿润的淀粉碘化钾试纸变蓝,故答案为:湿润的淀粉碘化钾试纸变蓝;
(4)根据电解饱和食盐水的电解原理方程式:2NaCl+2H2O?通电?.?2NaOH+H2↑+Cl2↑,当产生的H2的体积为44.8mL0.002mol时,生成氢氧化钠的物质的量为0.004mol,所以溶液中NaOH的物质的量浓度=0.004mol0.05L=0.08mol/L,
故答案为:0.08mol/L;
(5)在甲烷燃料电池中,负极上失电子的是燃料甲烷,在碱性环境下电极反应为:CH4-8e-+10OH-=CO32-+7H2O,正极上得电子的是氧气,在碱性环境下电极反应为:2O2+8e-+4?H2O=8OH-,
故答案为:CH4-8e-+10OH-=CO32-+7H2O;2O2+8e-+4?H2O=8OH-.
本题解析:
本题难度:一般
5、选择题 将纯锌片和纯铜片按下图示方式插入同浓度同体积的稀硫酸中一段时间,以下叙述正确的是

[? ]
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
参考答案:C
本题解析:
本题难度:一般
|