1、选择题 已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系式正确的是
A.质子数:c>b
B.离子的还原性:Y2->Z-
C.氢化物的稳定性:H2YD.原子半径:X
参考答案:BC
本题解析:试题分析:aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,说明离子的核外电子数相等,则a-3=b-1=c+2=d+1,A不正确。核外电子排布相同的微粒,其离子半径随原子序数的增大而减小,B正确。根据原子序数及所带电荷数可知,W和X是金属,其中W位于X的右侧。Y和Z是非金属,其余W和X的上一周期,其中Z位于Y的右侧,所以选项C正确,D不正确,答案选BC。
考点:考查元素周期表的结构、元素周期律的应用
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:简单
2、推断题 已知A、B、C、D、E、F为周期表前四周期原子序数依次增大的六种元素。其中A是元素周期表中原子半径最小的元素,B原子最外层电子数是内层电子数的2倍。D、E为同主族元素,且E的原子序数为D的2倍。F元素在地壳中含量位于金属元素的第二位。试回答下列问题:
(1)F元素价层电子排布式为?____________________。
(2)关于B2A2的下列说法中正确的是?________________。
A.B2A2中的所有原子都满足8电子结构?
B.每个B2A2分子中σ键和π键数目比为1:1
C.B2A2是由极性键和非极性键形成的非极性分子?
D.B2A2分子中的B-A键属于s—pσ键
(3)B和D形成的一种三原子分子与C和D形成的一种化合物互为等电子体,则满足上述条件的B和D形成的化合物的空间构型是?________________。
(4)C元素原子的第一电离能比B、D两元素原子的第一电离能高的主要原因____________
(5)A与D可以形成原子个数比分别为2:1,1:1的两种化合物X和Y,其中?Y含有_____________键(填“极性键”“非极性键”),A与C组成的两种化合物M和N所含的电子数分别与X、Y相?等,则M的电子式为_____________?,N的结构式为______________。
(6)E的氢化物的价层电子对互斥理论模型为?_______,E?原子的杂化方式为?_________杂化。
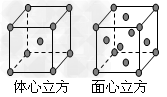
(7)F单质的晶体在不同温度下有两种堆积方式,晶胞分别如右图所示。面心立方晶胞和体心立方晶胞的棱边长分别为acm、bcm,则F单质的面心立方晶胞和体心立方晶胞的密度之比为____________,F原子配位数之比为_____________。
参考答案:(1)3d64s2;?
(2)CD
(3)直线型?
(4)C元素原子的最外层电子的p轨道处于半充满状态,能量低,较稳定,失去第一个电子需要的能量较B、D多?
(5)极性键、非极性键 ;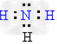 ?;
?;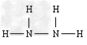
(6)四面体形;sp3;?
(7)2b3:a3 ;3:2
本题解析:
本题难度:一般
3、选择题 短周期元素A、B、C,它们的原子序数依次增大,其中C的原子半径在短周期的主族元素中最大,B与C的最外层电子数之和等于A的最外层电子数的2倍,且A是构成有机物的重要元素,下列说法正确的是
A.A元素位于元素周期表中第二周期ⅥA族
B.B离子与C离子的电子排布相同
C.C离子具有很强的还原性,B离子具有很强的氧化性
D.B、C可以形成BC2型化合物
参考答案:B
本题解析:
本题难度:一般
4、选择题 硒为第四周期VIA族元素,根据它在周期表中的位置推断,硒可能具有的性质为( )
A.单质硒在通常状况下是气体
B.SeO3的水化物呈碱性
C.H2Se比H2S稳定
D.硒元素有+4、+6、-2三种常见价态
参考答案:A.氧族元素从上到下单质的熔沸点逐渐升高,S在常温下为固体,则Se为固体,故A错误;
B.SeO3为酸性氧化物,对应的水化物为H2SeO4,溶液呈酸性,故B错误;
C.同主族元素从上到下元素的非金属性逐渐减弱,对应氢化物的稳定性逐渐减弱,则稳定性:H2Se<H2S,故C错误;
D.硒为第四周期VIA族元素,与S元素在周期表同一主族,常见化合价有+4、+6、-2三种常见价态,与S相似,故D正确.
故选D.
本题解析:
本题难度:一般
5、简答题 下表是元素周期表的一部分.
族
周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA
1
① |
2
②
③
④
⑤
⑥
3
⑦
⑧
⑨
⑩
|
(1)表中元素⑩的氢化物的化学式为______,此氢化物的还原性比元素⑨的氢化物的还原性______(填强或弱)
(2)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是______,其单质的电子式为______.
(3)俗称为“矾”的一类化合物通常含有共同的元素是______
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质.写出元素③的氢氧化物与NaOH溶液反应的化学方程式______又如表中与元素⑦的性质相似的不同族元素是______(填元素符号)
参考答案:由元素在周期表中的位置可知,①为H,②为Li,③为Be,④为B,⑤为N,⑥为O,⑦为Mg,⑧为Al,⑨为S,⑩为Cl,
(1)元素⑩为Cl,为-1价,其氢化物的化学式为HCl;非金属性Cl>S,非金属性越强,氢化物的还原性越弱,故H2S的还原性更强,
故答案为:HCl,弱;
(2)元素原子的核外p电子数比s电子数少1,核外电子排布为1s22s22p3,则该元素的元素符号是N,氮气分子中氮原子之间形成3对共用电子对,故氮气的电子式为 ,
,
故答案为:N; ;
;
(3)俗称为“矾”的一类化合物,是某些含有结晶水的金属硫酸盐,都含有H、O、S元素,
故答案为:H、O、S;
(4)元素Be与元素Al的氢氧化物有相似的性质,处于周期表对角线位置,已知:Al(OH)3+NaOH=NaAlO2+2H2O,Al(OH)3具有两性,则也具有两性,能与NaOH溶液反应生成盐和水,反应的化学方程式为Be(OH)2+2NaOH═Na2BeO2+2H2O,
与元素Mg的性质相似的不同族、不同周期元素是Li,
故答案为:Be(OH)2+2NaOH═Na2BeO2+2H2O;Li.
本题解析:
本题难度:一般