1、选择题 浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是
[? ]
A.酸性
B.脱水性
C.强氧化性
D.吸水性
参考答案:A
本题解析:
本题难度:简单
2、选择题 在硫酸的工业制法中,下列生产操作与说明生产操作的主要原因两者都是正确的是( )
A.硫铁矿燃烧前粉碎得越细越好,因为大块的硫铁矿燃烧不完全
B.从沸腾炉出来的炉气需净化,因为炉气中SO2会与杂质反应
C.SO2氧化为SO3时需使用Fe做催化剂,这样可以无需加热
D.用98.3%的硫酸吸收SO3,目的是为了防止形成酸雾,以便使SO3吸收完全
参考答案:D
本题解析:
本题难度:简单
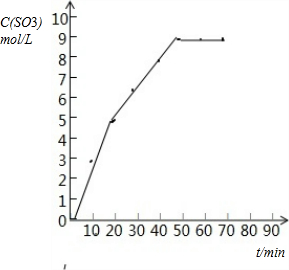
3、简答题 (1)下表为某温度和压强下,密闭容器中SO2氧化为SO3反应在不同时间各物质的浓度(mol/L)
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70
|
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1
|
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5
|
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9
|
试画出V(SO3)-t图.
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO2:7%,O2:11%,N2:82%):
压强/MPa
温度/℃ | 0.1 | 0.5 | 1 | 10
400
99.2%
99.6%
99.7%
99.9%
500
93.5%
96.9%
97.8%
99.3%
600
73.7%
85.8%
89.5%
96.4%
|
①如何利用表中数据推断SO2的氧化反应的热效应?______.
②在400一500℃时,SO2的催化氧化采用常压而不是高压,主要原因是:______.
③工业制硫酸所产生的尾气含有SO2、微量的SO3和酸雾.为了保护环境将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式:______.
④能用于测定硫酸尾气中SO2含量的是______.(填字母)
A.NaOH溶液、酚酞试液 ?
B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液
D.氨水、酚酞试液
⑤某温度下,SO2氧化为SO3在10L的密闭容器中进行,开始向容器加入4.0mol?SO2和10.0mo1O2,当反应达到平衡时,混合气体为13.0mol,则SO2的转化率为______,该温度反应的平衡常数______.
参考答案:(1)根据表中数据分析,起点三氧化硫生成的量为0,反应到50min后,三氧化硫浓度不再变化,说明已达到平衡,依据各点数据在坐标系中描点连线,画出变化曲线如图:
故答案为:

;
(2)①依据数据分析,压强一定时,温度升高,二氧化硫的转化率减小,说明升温平衡向逆反应方向移动,所以二氧化硫的氧化反应为放热反应,
故答案为:压强一定时,温度升高,二氧化硫的转化率减小,说明升温平衡向逆反应方向移动,所以二氧化硫的氧化反应为放热反应;
②压强及温度对S02转化率的影响依据表中数据,400℃~500℃时,1标准大气压时二氧化硫转化率为97.8%、99.7%;10大气压时二氧化硫转化率为99.3%、99.7%;对比数据可知,增大到10个大气压,二氧化硫转化率变化不大,但增大压强会对设备要求更高,成本高,所以工业上直接采用常压;
故答案为:从化学平衡移动条件分析应该采用低温高压.而根据表格中提供的数据发现,压强的增加引起SO2转化率的变化并不明显,反而增加成本,所以工业上直接采用常压;
③尾气含有S02、微量的S03和酸雾,其中二氧化硫会发生反应生成亚硫酸、亚硫酸铵、亚硫酸氢铵,这些物质易被氧化;故答案为:2H2SO3+O2=2H2SO4; 2NH4HSO3+O2=2NH4HSO4;2(NH4)2SO3+O2=2(NH4)2SO4中的任意两个;
④测定硫酸尾气中S02含量,尾气中含有三氧化硫,需要加入与二氧化硫反应的试剂,不与三氧化硫反应,且现象明显;Na0H溶液、酚酞试液和氨水、酚酞试液;和二氧化硫、三氧化硫反应,所以不能准确测定二氧化硫的含量;KMnO4溶液、稀H2SO4和二氧化硫反应,全部反应的现象是到溶液紫红色恰好褪去;和碘水、淀粉溶液反应,二氧化硫全部反应的现象是蓝色恰好变为无色;上述高锰酸钾、碘单质和二氧化硫反应,与三氧化硫不反应,所以利用反应,计算被试剂吸收的二氧化硫,得到二氧化硫的含量;故答案为:BC.
⑤根据二氧化硫氧化为三氧化硫的反应列式计算,设变化的二氧化硫物质的量为X
? 2SO2 +O2 催化剂.△?2SO3
起始量(mol)?4.0? ?10.0? ?0
变化量(mol)? X? 0.5X? ?X
平衡量(mol) 4.0-X? 10.0-0.5X? ? X
(?4.0-X?)+(10.0-0.5X?)+X=13.0?
解得X=2mol
二氧化硫的转化率=2mol4mol×100%=50%,k=[SO3]2[O2][SO2]2=(210)29×(210)2=1.1L?mol-1
故答案为:50%;1.1L?mol-1
本题解析:
本题难度:一般
4、填空题 (1)碳与浓硫酸在加热的条件下发生的反应为:
C+2H2SO4(浓)
2H2O+CO2↑+2SO2↑,其中碳元素的化合价______(填“升高”或“降低”),被______(填“氧化”或“还原”,下同):碳单质作______剂,具有______性.
(2)将适量的蔗糖放入烧杯中,加入几滴水,搅拌均匀,然后再加入适量浓硫酸,迅速搅拌,放出大量的热,同时观察到蔗糖逐渐变黑,体积膨胀,并产生刺激性气味的气体.根据上述实验现象,说明浓硫酸具有______(填序号).①强氧化性②脱水性③吸水性④酸性.
参考答案:(1)因反应物化合价升高,本身被氧化,是还原剂,具有还原性,反应物化合价降低,本身被还原,是氧化剂,具有氧化性,C元素的化合价由0价升高到+4价,
故答案为:升高;氧化;还原;还原;
(2)因浓硫酸具有吸水性,浓硫酸吸水稀释而放出大量的热,浓硫酸将蔗糖中的H和O以2:1的形式脱去,蔗糖变黑;浓硫酸具有强氧化性:C+2H2SO4(浓)△.CO2↑+2SO2↑+2H2O,产生有刺激性气味的气体,故答案为:①②③.
本题解析:
本题难度:一般
5、填空题 在某有机物A的结构简式如右图。请回答
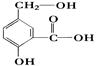
(1)A跟NaOH溶液反应的化学方程式是:?。
(2)A跟NaHCO3溶液反应的化学方程式是:?。
(3)A在一定条件下跟Na反应的化学方程式是:?。
参考答案:
(1)
(2)
(3)
本题解析:略
本题难度:简单