1、填空题 (10分)美国Bay等工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如右图:

(1)此流程的第II步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式为K=?;反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的化学平衡常数表达式为K=?;反应的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 830
| 1000
|
平衡常数K
| 10
| 9
| 1
| ?
|
从上表可以推断:此反应是?(填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入CO与H2O均为1mo1,则达到平衡后CO的转化率为?。
(2)在830℃,以下表的物质的量(单位为mol)投入恒容反应器发生上述第II步反应,其中反应开始时,向正反应方向进行的有?(填实验编号);
实验编号
| n(CO)
| n(H2O)
| n(H2)
| n(CO2)
|
A
| 1
| 5
| 2
| 3
|
B
| 2
| 2
| 1
| 1
|
C
| 0.5
| 2
| 1
| 1
|
(3)在一个不传热的固定容积的容器中,判断此流程的第II步反应达到平衡的标志是?。
①体系的压强不再发生变化?②混合气体的密度不变
③混合气体的平均相对分子质量不变?④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化?⑥v(CO2)正=v(H2O)逆
(4)右图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件浓度发生变化的情况:图中t2时刻发生改变的条件是(写出两种)?。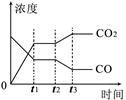
参考答案:(1)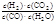 (1分)?放(1分)? 50%(2分)?
(1分)?放(1分)? 50%(2分)?
(2)B(2分)?
(3)④⑤⑥(2分)?
(4)降低温度,或增加水蒸汽的量,或减少氢气的量(2分)
本题解析:(1)分析表格数据,得:升温K值减小,即平衡逆向移动,说明逆向是吸热反应,则正向为放热反应;
830℃? CO(g)+H2O(g) H2(g)+CO2(g)
H2(g)+CO2(g)
n0? 1mo1? 1mo1? 0? 0
n? x? x? x? x
n(平衡)1-x? 1-x? x? x
则K=x2/(1-x)2=1,求解,得:x="0.5" mo1
所以,达到平衡后CO的转化率=x/1mo1=50%;
(2)利用Q与K的关系求解;利用Q=[C(H2)C(CO2)]/[C(CO)C(H2O)],依次求得Q(A)=1.2、Q(B)=0.25、Q(C)=1;要正向进行,则Q<K,故选B;
(3)因反应前后气态物质系数相等,则无论是否达平衡态,压强都不变,故①不是反应达到平衡的标志;②混合气体的密度=m(气体)/V,因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,“固定容积的容器”则V为一定值,故②不是反应达到平衡的标志;③混合气体的平均相对分子质量= m(气体)/n(气体),因为各物质均为气体,由“质量守恒”得:无论是否达平衡态,m(气体)为一定值,由化学方程式系数得:无论是否达平衡态,n(气体)为一定值,故③不是反应达到平衡的标志;④是;⑤该反应为放热反应,则体系的温度不变,说明达到了平衡态;⑥是;
(4)分析图像可以看出:在t2时刻,因条件的改变使C(CO2)增大、C(CO)减小,说明平衡正向移动;但不能是增大C(CO)使平衡正向移动(因增大C(CO),能使平衡正向移动,C(CO2)增大,但C(CO)也增大)
本题难度:一般
2、选择题 在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )
A.光照一段时间后,c(HClO)减小
B.加入碳酸钙粉末后,溶液的pH增大,可以提高HClO浓度
C.加入少量水,由水电离的c(H+)减小
D.加入少量NaOH固体,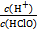 增大
增大
参考答案:B
本题解析:A选项,光照HClO分解使平衡右移,HClO均减小;B选项,碳酸钙消耗H+,正确;C选项,加入少量水使HCl、HClO浓度减小,水的电离程度增大,错误;D选项,NaOH与H+反应,上述比值减小
本题难度:一般
3、选择题
aA(g) bB(g)
bB(g)
达平衡后,保持温度不变,将容器容积增加一倍,新平衡建立时,cB是原来的 60%,则(? )
A.平衡向正反应方向发生了移动
B.A 物质的转化率变小了
C.B 物质的质量分数增大了
D.a>b
参考答案:AC
本题解析:虚拟一种中间状态,假设平衡不移动,则新平衡建立时:cB是原来的 50%,而事实上cB是原来的 60%,这表明扩大容积平衡向生成 B 的方向——正反应方向发生了移动。
本题难度:一般
4、填空题 化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题:
 (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)?
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)?
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| Na2SO4
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 7.0
|
?
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN? B.HClO? C.H2SO4? D.CH3COOH? E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。
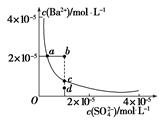
A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp
参考答案:(1)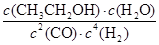
(2)①CO32-?②C A
③溶液变浑浊 CO32-+2Na++CO2+H2O=2NaHCO3↓
④2Cl2+CO32-+H2O=CO2↑+2Cl-+2HClO
(3)B
本题解析:(1)根据化学平衡常数的定义,结合化学方程式,可写出K=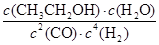
。(2)据“越弱越水解”,酸性顺序为:CH3COOH>H2CO3>HClO>HCN>HCO3-,酸越弱,其阴离子结合质子能力越强。硫酸为强酸,浓度均为0.01 mol·L-1的五种物质的溶液中,硫酸的酸性最强;稀释100倍后,弱酸还能继续电离,故pH变化最小的是HCN;据酸性顺序,碳酸钠溶液只能跟盐酸反应,而不与HClO反应。(3)a点、c点达平衡状态,对应c(Ba2+)和c(SO42-)的乘积等于Ksp,它只受温度影响;a点、c点对应的Ksp相等,D项正确;b点、d点均未达平衡状态,由于d点对应c(Ba2+)和c(SO42-)的乘积小于BaSO4的Ksp,故无BaSO4沉淀生成,C项正确;通过加水稀释后c(Ba2+)和c(SO42-)同时减少,不能使溶液由b点变到a点,B项错误。
本题难度:一般
5、选择题 在体积可变的密闭容器中,反应mA(g)+nB(s)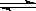 pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中正确的是
A.(m+n)必定小于p
B.(m+n)必定大于p
C.m必定小于p
D.n必定大于p
参考答案:C
本题解析:略
本题难度:一般