|
高中化学知识点讲解《反应速率与平衡的有关计算》考点特训(2017年冲刺版)(六)
2017-11-11 04:24:41
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (5分)汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)===N2(g)+2CO2(g),在298 K、100 kPa下,ΔH=-113 kJ·mol-1,ΔS=-145 J·(mol·K)-1.
(1)为了提高该反应的速率和NO的转化率,采取的正确措施为?
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
| (2)若升高温度,则该反应的平衡常数??(填“增大”、“减小”或“不变”).
(3)判断该条件下反应?(填能、不能)自发.
参考答案:(1)B(1分) (2)减小(2分)(3)能(2分)
本题解析:略
本题难度:简单
2、选择题 据报道,在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实,其反应的化学方程式为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是 CH3CH2OH(g)+3H2O(g) 。 下列叙述正确的是
A.当v(CO2)=2v(CH3CH2OH)时,反应一定达到平衡状态
B.当平衡向正方向移动时,平衡常数一定增大
C.增大压强,可提高CO2和H2的转化率
D.相同条件下,2 mol氢原子所具有的能量等于1 mol氢分子所具有的能量
参考答案:C
本题解析:A.当v(CO2)=2v(CH3CH2OH)时,没有说明方向问题,无法判断是否达到平衡状态,错误;B、平衡常数只与温度有关,温度不变,平衡常数就是定值;D、因为 2 mol氢原子生成1 mol氢分子过程中释放能量,所以前者的能量高于后者;
本题难度:一般
3、选择题 在一个固定体积的密闭容器中,通入3L?X?气体和2L?Y?气体,在一定条件下发生下列反应:4X(g)+3Y(g)═2Q(g)+nR(g).反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,X的浓度减小 ,则该反应方程式中的n值为( )
A.3
B.5
C.6
D.7
参考答案:假设通入3molX?气体和2molY气体,X的浓度减小13,则反应的X为1mol,则
? ?4X(g)+3Y(g)═2Q(g)+nR(g)
起始:3mol? 2mol? 0? 0
转化:1mol?0.75mol? 0.5mol? 0.25nmol
平衡:2mol? 1.25mol? 0.5mol? 0.25nmol
在相同温度和体积的容器中,气体的物质的量之比等于压强之比,反应达到平衡后,容器内温度不变,混合气体的压强比原来增加5%,
则有2+1.25+0.5+0.25n3+2=1.051,
n=6,
故选C.
本题解析:
本题难度:一般
4、选择题 可以证明可逆反应N2+3H2 2NH3已达到平衡状态的是: 2NH3已达到平衡状态的是:
①一个N≡N键断裂的同时,有3个H-H键断裂?
②其它条件不变时,混合气体平均式量不再改变
③保持其它条件不变时,体系压强不再改变?
④恒温恒容时,密度保持不变
⑤NH3%不再改变?⑥2υ正(H2)=3υ逆(NH3)
⑦容器内三种气体共存?⑧N2、H2、NH3分子式之比为1:3:2
A.全部
B.只有①③⑤
C.②③⑤⑥
D.只有③⑤⑥
参考答案:C
本题解析:①错,反应每时每刻均这样进行;④错,恒温恒容,体系内气体总质量不变,即每时每刻体系内的密度均保持不变;
本题难度:一般
5、选择题 改变下列条件,能使N2(g)+3H2(g)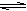 2NH3(g) △H<0平衡向逆反应方向移动的是 2NH3(g) △H<0平衡向逆反应方向移动的是
A.升高温度
B.增大压强
C.增大H2的浓度
D.使用催化剂
参考答案:A
本题解析:反应N2(g)+3H2(g)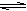 2NH3(g) △H<0的正反应是应该气体体积碱性的放热反应。A.根据平衡移动原理,升高温度化学平衡向吸热反应方向即逆反应方向移动。正确。B.根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向就是正反应方向移动。错误。C.根据平衡移动原理,增大反应物H2的浓度,化学平衡向正反应方向移动。错误。D.使用催化剂,能改变化学反应速率,但对于化学平衡的移动无影响。错误。 2NH3(g) △H<0的正反应是应该气体体积碱性的放热反应。A.根据平衡移动原理,升高温度化学平衡向吸热反应方向即逆反应方向移动。正确。B.根据平衡移动原理,增大压强,化学平衡向气体体积减小的方向就是正反应方向移动。错误。C.根据平衡移动原理,增大反应物H2的浓度,化学平衡向正反应方向移动。错误。D.使用催化剂,能改变化学反应速率,但对于化学平衡的移动无影响。错误。
本题难度:一般
|