1、选择题 在一个固定体积的密闭容器中,加入2mol A和1mol B发生反应: ,达到平衡时,C的物质的量百分含量为w,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的物质的量百分含量大于w的是
,达到平衡时,C的物质的量百分含量为w,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的物质的量百分含量大于w的是
A.
B.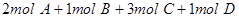
C.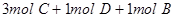
D.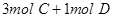
2、填空题 (15分)500℃时,将SO2和O2置于一容积固定为2 L的密闭容器中发生反应。反应过
程中SO2、O2和SO3物质的量变化如图所示,请回答下列问题:(1)反应10 min至15 min,
O2的平均反应速率为??mol·(L·min)-1,比反应开始时前10 min速率 ,可能的原
因是 。

(2)从曲线变化可以看出,反应进行至25min时,采取了 使得平衡向
方向移动,达到新平衡后SO2的体积分数比原平衡小。
3、计算题 (8分)在密闭容器中,将2.0 mol CO与10mol H2O混合加热到800℃,达到下列平衡:
CO(g)+H2O(g)  CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
CO2(g)+H2(g) K=1.0,则CO的转化率为________。在800℃,若上述反应体系中各物质的浓度分别为c(CO)=2.0mol?L-1,c(H2O)=6.0mol?L-1,c(CO2)=3.0mol?L-1,c(H2)= 4.5mol?L-1,则此时该反应向_________方向移动。
4、计算题 将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+ B(g)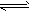 xC(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,c (A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min)。求:
xC(g) + 2D(g),经5min后测得D的浓度为0.5mol/L,c (A)∶c(B)=3∶5,C的平均反应速率是0.1mol/(L·min)。求:
(1)此时A的浓度及反应开始前放入容器中A、B物质的量;
(2)B的平均反应速率;
(3)x值是多少?
5、填空题 在一定温度下,向一个容积不变(1 L)的密闭容器中,加入3 mol PCl3和4 mol Cl2使之发生反应
PCl3(g)+Cl2(g) PCl5(g),平衡时容器内压强为开始时的6/7。计算并回答
PCl5(g),平衡时容器内压强为开始时的6/7。计算并回答
(1) 平衡时,容器内气体密度是开始时的________倍,气体平均相对分子质量是开始时的________倍。
(2)保持同一反应温度,若将起始物改为a mol PCl3,b mol Cl2,c mol PCl5。欲使平衡时PCl5的体积分数为1/6,则a,b,c满足的关系为_________,_________。欲使开始时反应向逆方向进行,则a的取值范围为
_______, b的取值范围为__________,c的取值范围为________。
(3) 保持同一反应温度,若将起始物改为3 mol PCl3,3 mol Cl2,达到平衡时PCl3的转化率为________(百分数表示,保留一位小数;已知: )
)