1、选择题 短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是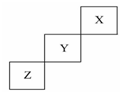
A.X的单质的熔点比Z的低
B.Y的氢化物的稳定性比Z的弱
C.Y的最高正化合价为+7
D.X、Y、Z三种元素中,X的非金属性最强
参考答案:A
本题解析:短周期元素X、Y、Z在元素周期表中的位置可知,X应该是He,Y应该是F,Z应该是S。F元素的非金属性强于S的,所以HF的稳定性强于H2S的,B不正确;F是最活泼的非金属,没有正价,C不正确;He是稀有气体,最不活泼,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生能力的培养与学习方法的指导与训练。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:简单
2、选择题 下列轨道表示式表示的原子基态(能量最低状态)核外电子排布正确的(?)
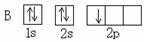
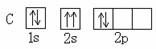 A? B
A? B
?
C ? D
参考答案:B
本题解析:根据洪特规则电子总是自旋方向相同的分别占据不同的简并轨道,A选项中2s轨道的两个电子自旋方向相同,A错误;C选项中2s轨道中两个电子的自旋方向相同,C错误;2p轨道的3个电子自旋方向应该相同,D错误;所以答案选B。
本题难度:一般
3、选择题 焰色反应可用来检验
A.所有元素的存在
B.所有金属单质的存在
C.某些金属单质或金属离子的存在
D.所有非金属元素的存在
参考答案:C
本题解析:试题分析:焰色反应只能用来检验某些金属元素的存在,不能检验所有元素或所有金属或非金属元素,A、B、D错误,C正确。
考点:考查焰色反应的检验对象
点评:紧扣焰色反应的定义即可。属于简单题。
本题难度:困难
4、选择题 镭是元素周期表中第七周期的ⅡA族元素。下面关于镭的性质的描述中不正确的是
A.在化合物中呈+2价
B.单质与水反应放出氢气
C.氢氧化物呈两性
D.镭的还原性大于镁
参考答案:C
本题解析:镭最外层有2个电子,在化合物中呈+2价,故A正确;同主族元素从上到下金属性逐渐增强,镭的金属性较强,单质性质活泼,与水反应放出氢气,故B正确;镭的金属性较强,氢氧化物呈碱性,且为强碱,故C错误;同主族元素从上到下金属性逐渐增强,镭的还原性大于镁,故D正确,答案选C。
点评:该题是基础知识试题的考查,主要是考查学生灵活运用元素周期律解决实际问题的能力。注意从同主族元素金属性对应单质、化合物的性质的相似性和递变性的角度解答该题,有利于培养学生的逻辑推理能力和知识的迁移能力,题目难度不大。
本题难度:一般
5、填空题 (14分)下表是周期表中的一部分,根据a—n在周期表中的位置,按要求回答问题:
?
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| 0
|
1
| a
| ?
| ?
|
2
| ?
| ?
| ?
| b
| c
| ?
| d
| e
|
3
| f
| g
| h
| i
| j
| k
| m
| n
|
(1)表中元素,只有负价而无正价的元素是?,氧化性最强的单质是?。(本小题均填物质的名称)
(2)最高价氧化物的水化物中碱性最强的是?,呈两性的是?,写出它与氢氧化钠反应的离子方程式? 。(本小题均用化学式表示)
(3)在b、c、d、f、g、h中,原子半径从大到小的顺序为的是?。(用元素符号表示)。
(4) 比较k、m的气态氢化物的稳定性?。(用化学式表示)
参考答案:(1)氟、氟气(2)Na、AL、 AL(OH)3 + OH-=Al3+?+ 2H2O(3)Na>Mg>Al>C>N? (4)H2S<HCl
AL(OH)3 + OH-=Al3+?+ 2H2O(3)Na>Mg>Al>C>N? (4)H2S<HCl
本题解析:(1)表中元素,只有负价而无正价的元素为非金属性最强的元素即为F(氟),氧化性最强的单质即为得电子能力最强的为氟气;
(2)最高价氧化物的水化物中碱性最强的即为元素金属性最强的元素Na,呈两性的是AL,与氢氧化钠溶液反应的离子方程式为:AL(OH)3 + OH-=Al3+?+ 2H2O;
(3)在b、c、d、f、g、h中,原子半径从大到小的顺序为的是:Na>Mg>Al>C>N;
(4)k、m的气态氢化物的稳定性为:H2S<HCl;
本题难度:一般