1、填空题 (12分)A、B、C为短周期元素,在周期表中所处位置如图所示。A、C两元素的原子核外电子数之和等于B原子的质子数。
(1)B位于元素周期表第______周期, 第_______族。
第_______族。
(2)A元素形成的单质的电子式为:____________________________。
(3)在A B、C的气态氢化物中最稳定的是____________________。
(4)C的离子结构示意图为________________________。
(5)写出A的气态氢化物与B的最高价氧化物对应水化物反应的化学方程式____________________________________________。
参考答案:(1)? 3?ⅥA? (2)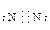 ?
?
(3)HF? (4)
(5) 2NH3+H2SO4=( NH4)2SO4 (每空2分)
本题解析:略
本题难度:一般
2、选择题 下图为元素周期表中短周期的一部分,下列说法错误的是
?
A.W的原子序数可能是Y的两倍
B.单质的活泼性可能是Y>Z
C.气态氢化物的稳定性X<Y
D.Y、W的最高价氧化物对应水化物可能均为强酸
参考答案:D
本题解析:由元素周期表的结构可知,X、Y一定位于第二周期,Z、W一定位于第三周期。如果Y的原子序数为x,则与之相邻同主族元素W的原子序数为x+8,x+8=2x时,x=8、x+8=16,即Y、W分别为第VIA族的氧、硫,故A正确;讨论:①若四种元素均为金属,根据同周期金属性递减、同主族金属性递增规律可知,金属性:Y<W<Z,则金属单质的活泼性:Y<W<Z;②若四种元素均为非金属,根据同周期非金属性递增、同主族非金属性递减规律可知,非金属性:Y>W>Z,则非金属单质的活泼性:Y>W>Z,故B正确;同周期非金属性递增,则非金属性:X<Y,非金属性越强,气态氢化物的稳定性越强,故C正确;氟无+7价、氧无+6价,则Y、W可能是位于第VA、IVA、IIIA、IIA、IA族,讨论:①若Y、W是N、P,HNO3是强酸,H3PO4是中强酸;②若Y、W是C、Si,H2CO3、H2SiO3都是弱酸;③若Y、W是B、Al,H3BO3是弱酸,Al(OH)3是两性氢氧化物;④若Y、W是Be、Mg,Be(OH)2是弱酸,Mg(OH)2是中强碱;⑤若Y、W是Li、Na,LiOH是中强碱,NaOH是强碱,故D错误。
本题难度:一般
3、选择题 国际无机化学命名委员会将长式元素周期表原先的主、副族号取消,从左往右改为18列,碱金属为第 1列,稀有气体为18列。按这个规定,下列说法错误的是
1列,稀有气体为18列。按这个规定,下列说法错误的是
A.只有第2列元素的原子最外层有2个电子
B.第3~12列中的元素都是金属元素
C.室温时,第18列元素的单质都是气体
D.第16、17列元素都是主族元素
参考答案:A
本题解析:略
本题难度:一般
4、选择题 下列各组元素属于p区的是( )
A.原子序数为1、2、7的元素
B.O、S、P
C.Fe、Ar、Cl
D.Na、Li、Mg
参考答案:B
本题解析:A中1号为氢,为s区;C中Ar、Cl为p区,Fe为d区;D项均为s区。
本题难度:一般
5、选择题 短周期的两种元素A和B,它们的离子A-和B2+具有相同的电子层结构,下列说法中正确的是(?)
A.原子序数A>B
B.电子总数A->B2+
C.离子半径A->B2+
D.原子半径A>B
参考答案:C
本题解析:因为离子A-和B2+具有相同的电子层结构,即可确定元素A、B在周期表中的相对位置如下: ,所以原子序数B>A,原子半径:B>A,离子的电子层结构相同,则电子总数相等,离子半径A->B2+。
,所以原子序数B>A,原子半径:B>A,离子的电子层结构相同,则电子总数相等,离子半径A->B2+。
本题难度:一般