1、选择题 有关化学用语正确的是( )
A.次氯酸的电子式:H:Cl:O:
B.二氧化硅的分子式:SiO2
C.氮气的结构式:
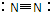
D.氯化镁的电子式:
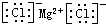
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列有关物质的表达式不正确的是( )
A.二甲醚的分子式:C2H6O
B.醛基的结构简式:-CHO
C.葡萄糖的结构简式:CH2OH(CHOH)4CHO
D.溴乙烷的电子式
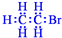
参考答案:D
本题解析:
本题难度:简单
3、选择题 美国科学家在《Science》上发表论文,宣布发现了铝的“超级原子”结构--Al13和Al14.?已知这类“超级原子”最外层电子数之和为40个时处于相对稳定状态.下列说法中,正确的是
[? ]
A.Al13、Al14互为同位素
B.Al13超原子中Al原子间通过离子键结合
C.Al14最外层电子数之和为42,与第ⅡA族元素原子的性质相似
D.Al13和Al14都具有较强的还原性,容易失去电子生成阳离子
参考答案:C
本题解析:
本题难度:简单
4、填空题 I.根据价层电子对互斥理论(VSEPR)可以判断分子或离子的空间构型。
请回答下列问题:
①解释CO2为直线型分子的原因?;
② PbCl2分子的立体构型为?,该分子属于?分子(填“极性”或“非极性” ),其中Pb原子的杂化轨道类型为?。
II.铜在我国有色金属材料的消费中仅次于铝,广泛地应用于电气、机械制造、国防等领域。回答下列问题:
(1)铜原子基态电子排布式为?;
(2)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属铜的测定得到以下结果:晶胞为面心立方最密堆积,边长为361pm。又知铜的密度为9.00g/cm3,则铜晶胞的体积是?
??cm3,晶胞的质量是?克,阿伏伽德罗常数为?
?(列式计算,已知Ar(Cu)=63.6)。
参考答案:I. (1) ①CO2属n+m=2,SP杂化,故为直线形?(每空2分)
②折线形(或V形)?极性分子? SP2?(每空1分)
II.(1)1s22s22p63s23p63d104s1?(2)4.70×10-23? 4.23×10-22
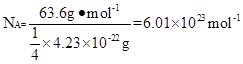
本题解析:I. (1)CO2中中心原子碳原子的孤对电子对数是(4-2×2)÷2=0,即碳原子是sp杂化,所以是直线型结构。
②PbCl2中中心原子Pb原子的孤对电子对数是(4-1×2)÷2=1,即Pb原子是sp2杂化,所以是V型结构。
II.(1)根据构造原理可知,基态铜原子的电子排布式为1s22s22p63s23p63d104s1 。
(2)边长是361pm,所以体积是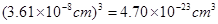 。根据密度可知晶胞的质量是
。根据密度可知晶胞的质量是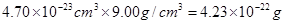 。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有
。由于铜晶胞中含有的铜原子数是8×1/8+6×1/2=4,所以有 ,因此
,因此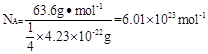 。
。
本题难度:一般
5、选择题 下列说法错误的是
A.主族元素的原子核外电子最后填入的能级是s能级或p能级
B.BF3、NCl3、H2O分子中所有原子都满足最外层为8电子结构的是NCl3
C.NH4+和CH4属于等电子体,立体构型都是正四面体
D.向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的Cu(OH)2沉淀
参考答案:D
本题解析:D错,向盛有硫酸铜溶液的试管里加入过量氨水,将得到蓝色的铜氨配合物溶液;
本题难度:一般