1、选择题 下列各个装置中能组成原电池的是?
[? ]
A﹑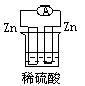
B﹑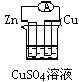
C﹑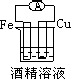
D﹑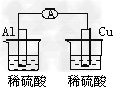
参考答案:B
本题解析:
本题难度:简单
2、选择题 某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则

A.电流方向:电极IV→ →电极I
→电极I
B.电极I发生还原反应
C.电极II逐渐溶解
D.电极III的电极反应:Cu2++2e-==Cu
参考答案:A
本题解析:A、由题意可知,该装置的I、II是原电池的两极,I是负极,II是正极,III、IV是电解池的两极,其中III是阳极,IV是阴极,所以电流方向:电极IV→ →电极I,正确;B、电极I是原电池的负极,发生氧化反应,错误;C、电极II是原电池的正极,发生还原反应,有Cu析出,错误;D、电极III是阳极,发生氧化反应,电极反应是Cu-2e-=:Cu2+,错误,答案选A。
→电极I,正确;B、电极I是原电池的负极,发生氧化反应,错误;C、电极II是原电池的正极,发生还原反应,有Cu析出,错误;D、电极III是阳极,发生氧化反应,电极反应是Cu-2e-=:Cu2+,错误,答案选A。
本题难度:一般
3、选择题
图甲中电极均为石墨电极,下列叙述中正确的是
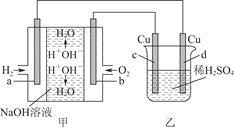
A.电子沿a→d→c→d路径流动
B.b极的电极反应为O2+4e-+4H+=2H2O
C.通电初期乙中的总反应为Cu+H2SO4  CuSO4+H2↑
CuSO4+H2↑
D.反应过程中,甲、乙装置中溶液的pH都逐渐减小
参考答案:C
本题解析:
电子可以沿着导线流动,在电解质溶液中是阴阳离子的移动产生电流,即电子沿a→d、c→b路径流动;电池电解质为NaOH,所以b电极的电极反应为O2+4e-+2H2O=4OH-;反应过程中,甲装置中产生水,所以溶液的pH减小,但是乙装置中由于H+被消耗,所以pH增大。
本题难度:一般
4、选择题 X、Y、Z、M、N代表五种金属,它们存在以下反应:
①水溶液中:X+Y2+=X2++Y
②只有Z能与冷水发生如下反应:Z+2H2O(冷水)=Z(OH)2+H2↑
③当M、N分别为电极与稀硫酸组成原电池时,负极的电极反应为:M-2e-=M2+
④N可以溶于稀硫酸,X不能被稀硫酸氧化
则这五种金属的活泼性由强到弱的顺序是( )
A.Z>X>Y>N>M
B.Z>M>N>X>Y
C.Z>Y>X>M>N
D.Y>M>N>Z>X
参考答案:①根据X+Y2+=X2++Y知,X的活动性顺序大于Y;
②Z能和水反应置换出氢气,则Z的活动性最强;
③当M、N分别为电极与稀硫酸组成原电池时,M失电子,则M的活动性顺序大于N;
④N可以溶于稀硫酸,则N处于氢元素之前,X不能被稀硫酸氧化,则X处于氢元素之后,
根据以上分析知,金属的活动性强弱顺序是:Z>M>N>X>Y,
故选B.
本题解析:
本题难度:一般
5、选择题 结合图判断,下列叙述正确的是( )

A.Ⅰ和Ⅱ中正极均被保护
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3[Fe(CN)6]溶液,均有蓝色沉淀
参考答案:A、题给装置I、II都是原电池,活泼金属作负极,首先被腐蚀,不活泼金属作正极,被保护;故A对;
B、I中的负极反应式为:Zn-2e-=Zn2+,而II中负极是铁,反应式为:Fe-2e-=Fe2+,故B错;
C、I溶液显中性,其电极反应式为:O2+2H2O+4e-=4OH-,而II溶液显酸性,电极反应式为:2H++2e-=H2↑,故C错;
D、I中没有Fe2+,不能与K3[Fe(CN)6]生成蓝色的Fe3[Fe(CN)6]2沉淀,故D错;
故选A.
本题解析:
本题难度:简单