1、选择题 下列说法正确的是
①用丁达尔效应可以区分食盐水和淀粉溶液
②标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4 L
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④由CaCO3的溶解度小于Ca(HCO3)2,可推出Na2CO3的溶解度小于NaHCO3
⑤在使Al溶解产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3-
⑥一种盐和另外一种盐反应不一定生成两种新盐
A.①⑤
B.①④
C.③⑥
D.①⑥
参考答案:D
本题解析:①淀粉是胶体,用丁达尔效应鉴别胶体和溶液,正确;②NO与O2反应生成NO2,体积小于22.4L,错误;③亚硫酸根离子能被硝酸氧化为硫酸根离子,对其产生干扰,错误;④Na2CO3的溶解度大于NaHCO3,错误;⑤在使Al溶解产生H2的溶液中为强酸性或强碱性溶液,碱性条件下Fe2+不共存,错误;⑥ 如 NaHCO3与NaHSO4反应生成Na2SO4一种盐,正确。
本题难度:一般
2、实验题 (15分)电石的主要成分为CaC2,易与水反应生成C2H2,故C2H2俗称电石气。某同学设计如下方案测定电石中CaC2的纯度(杂质不参加反应)。
实验原理:CaC2+2H2O=Ca(OH)2+C2H2↑
通过测定生成的气体的体积(标准状况),可确定样品中CaC2的含量。
实验步骤:
①取样品1.2g;
②把1.2 g样品放入气密性良好的气体发生装置,如图所示;

③向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平
④作为反应器的烧瓶中有24 mL液体。
请回答下列问题:
(1)上述实验所用的玻璃仪器有导管、水槽、 、 、 。
(2)若实验前有1000 mL、500 mL、250 mL的量筒备用,则应选用 mL的量筒。
(3)生成气体体积是 mL,为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是 。
(4)若将C2H2通入KMnO4溶液中,KMnO4溶液的紫红色会变浅,配平并完成化学方程式
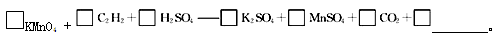
若该实验生成的C2H2完全被KMnO4溶液氧化,至少需0.1 mol ? L-1的KMnO4溶液 mL。
(5)通过以上数据计算,可得样品中CaC2的纯度为 。
参考答案:(1)圆底烧瓶、分液漏斗、量筒(3分) (2)500(2分)
(3)336; 使量筒内外液面相平、视线与量筒内液面的最低处相切(2+2=4分)
(4)2、1、3、1、2、2、4 H2O;(2分)300 (2分) (5)80%(2分)
本题解析:(1)根据装置图可知上述实验所用的玻璃仪器有导管、水槽、圆底烧瓶、分液漏斗、量筒。
(2)1.2g碳化钙最多生成标准状况下乙炔的体积是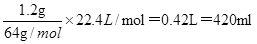 ,因此应选用500mL的量筒。
,因此应选用500mL的量筒。
(3)向样品中滴入水,至不再产生气泡,用量筒排水集气,量筒内液面在360mL处恰与水槽内液面相平。但由于作为反应器的烧瓶中有24 mL液体,则生成气体体积是360ml—24ml=336ml。由于气体的体积受温度和压强影响较大,所以为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是使量筒内外液面相平、视线与量筒内液面的最低处相切。
(4)乙炔中碳元素的化合价是—1价,反应后变为+4价,失去5个电子。高锰酸钾中锰元素的化合价从+7价降低到+2价,得到5个电子,则根据电子得失守恒和原子守恒可知配平后的方程式为2KMnO4+C2H2+3H2SO4=K2SO4+2MnSO4+2CO2+4H2O。乙炔的物质的量是0.336L÷22.4L/mol=0.015mol,则根据方程式可知需要高锰酸钾是0.03mol,所以至少需0.1 mol ? L-1的KMnO4溶液的体积是0.03mol÷0.1mol/L=0.3L=300mL。
(5)根据碳原子守恒可知样品中CaC2的物质的量是0.015mol,则纯度为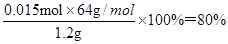 。
。
考点:考查电石含量测定实验方案设计与探究
本题难度:困难
3、选择题 下列反应中,水作为氧化剂的是
A.SO2与H2O反应
B.Al与NaOH溶液反应
C.NO2与H2O反应
D.Na2O2与H2O反应
参考答案:B
本题解析:A项,SO2与H2O反应属于非氧化还原反应;B项,Al与NaOH溶液反应本质是Al先与H2O反应:2A1+6H2O=2Al(OH)3+3H2↑,后Al(OH)3与NaOH继续反应:2Al(OH)3+2NaOH=2NaAlO2+4H2O,将两式相加得:2A1+2NaOH+2H2O=2NaAlO2+3H2↑,故Al是还原剂,H2O是氧化剂;C项,3NO2+H2O=2HNO3+NO,NO2既是氧化剂又是还原剂;D项,2Na2O2+2H2O=4NaOH+O2↑,2mol Na2O2中有1molNa2O2失去2 mol电子生成1 molO2,另1 mol Na2O2得到2 mol电子生成2molNaOH,即Na2O2既是氧化剂义是还原剂。
本题难度:简单
4、选择题 下列有关氧化还原反应的叙述 中,正确的是
中,正确的是
A.一定有氧元素参加
B.氧化剂本身发生氧化反应
C.氧化反应先于还原反应
D.一定有电子转移(得失或偏移)
参考答案:D
本题解析:略
本题难度:简单
5、选择题 下列说法中正确的是( )。
A.2 mol CH4的质量和O2的摩尔质量都是32 g
B.1 mol任何气体中都含有相同的原子数
C.0.5 mol NaCl约含有6.02×1023个离子
D.1 mol·L-1 KCl溶液中含有溶质1 mol
参考答案:C
本题解析:O2的摩尔质量为32 g/mol,A项不正确;气体有单原子分子如He,双原子分子如O2,三原子分子如O3,五原子分子如CH4等,B项不正确;D项未指明溶液的体积,不正确。
本题难度:简单